

Objetivo
Determinar la Bioequivalencia de dos formulaciones conteniendo 10 mg de Bisoprolol Fumarato en su forma farmacéutica tabletas entre el medicamento de prueba Colber y el medicamento de referencia Concor después de administrar una dosis oral de 10 mg de Bisoprolol Fumarato en una tableta y determinar en plasma, Bisoprolol, en 24 voluntarios clínicamente sanos, ambos géneros
Fase clínica
El estudio clínico se llevó a cabo bajo un diseño cruzado 2×2 no terapéutico a dosis única vía oral de10 mg de Bisoprolol Fumarato previo ayuno de 10 horas, la administración de los medicamentos prueba y referencia se realizó en forma aleatoria, a partir de dos tratamientos, dos periodos, dos secuencias (A-B, B-A) balanceado con 07 días de lavado entre los dos periodos.
Los medicamentos fueron administrados a 24 voluntarios clínicamente sanos, ambos géneros, a quienes se les tomaron 16 muestras sanguíneas en tubos con heparina de sodio, extrayéndose aproximadamente 10 mL de sangre en cada tiempo de muestreo correspondientes a: 0,00 (muestra blanco pre-tratamiento) 0,33; 0,66; 1,00; 1,50; 2,00; 2,50; 3,00; 4,00; 5,00; 7,00; 9,00; 12,00; 18,00; 24,00; 36,00 y 48,00 horas, las muestras fueron almacenadas en ultracongelación a temperatura no mayor de -50 grados centígrados, para su posterior análisis.
Fase analítica
La metodología analítica utilizada para determinar la concentración de Bisoprolol en plasma humano fue por Cromatografía de Líquidos acoplada a un sistema de detección por Espectrofotometría de Ms/Ms, realizado en un cromatógrafo UPLC modelo Acquity marca Waters con detector Ms/Ms modelo TQD marca Waters. A partir del plasma proveniente de cada uno de los 16 muestreos extraídos de los 24 voluntarios analizados, en cada uno de ellos se determinaron sus concentraciones plasmáticas. Posteriormente se realizó el análisis estadístico con el software Phoenix WinNonlin® versión 8.2 para determinar los valores farmacocinéticos que establecen la extensión y velocidad de la absorción del medicamento. Los valores de Cmáx (ng/mL) fueron obtenidos directamente de los datos observados experimentalmente para cada voluntario durante el estudio de bioequivalencia. Los valores de ABC0-t (h*ng/mL) fueron también obtenidos utilizando el software Phoenix WinNonlin® version 8.2 por el método de trapezoides, la constante de eliminación (ke) fue calculada por regresión log-lineal de la fase final de eliminación (λ) y a partir de tal se calculó la vida media de eliminación plasmática (t1/2) al dividir 0,693/ke. El área bajo la curva extrapolada al infinito (ABC0−∞) fue determinada sumando el cociente de la última concentración medida entre ke para cada voluntario durante el estudio de bioequivalencia.
Posteriormente, para determinar la existencia o no de bioequivalencia se aplicó el Intervalo de Confianza Clásico (ICCL), la Prueba t Doble Unilateral de Schuirmann (PDU) y de manera complementaria la Prueba de Anderson-Hauck (AH) a cada parámetro farmacocinético los cuales se determinaron con un valor de α=0,05 y un valor de β=0,20 para detectar diferencia entre el medicamento de prueba con el medicamento de referencia a partir de la transformación logarítmica de los parámetros Cmáx, ABC0-t y ABC0-inf obtenidos de Bisoprolol en las dos formulaciones evaluadas. El criterio de bioequivalencia se establece cuando el intervalo de confianza (IC) se encuentre entre el 80 y 125 % para el Cmáx y para el ABC así como la Prueba Doble Unilateral de Schuirmann (PDU) muestre un valor menor a 0,05. En caso de dictaminar bioequivalencia, la potencia será sólo de carácter informativo.
Resultados de la fase analítica
Se realizó el estudio clínico conforme al protocolo identificado como BQ-2019-39-BSP-E autorizado por COFEPRIS observando en todo momento la seguridad del voluntario. Se validó el método analítico para la cuantificación de Bisoprolol en plasma conforme lo estipulado en la NOM-177-SSA1-2013.
A continuación, se presentan los resultados de la concentración plasmática (Cp) obtenida para Bisoprolol en cada voluntario después de administrar el medicamento de referencia Concor (Tabla I) y el medicamento de prueba Colber (Tabla II).
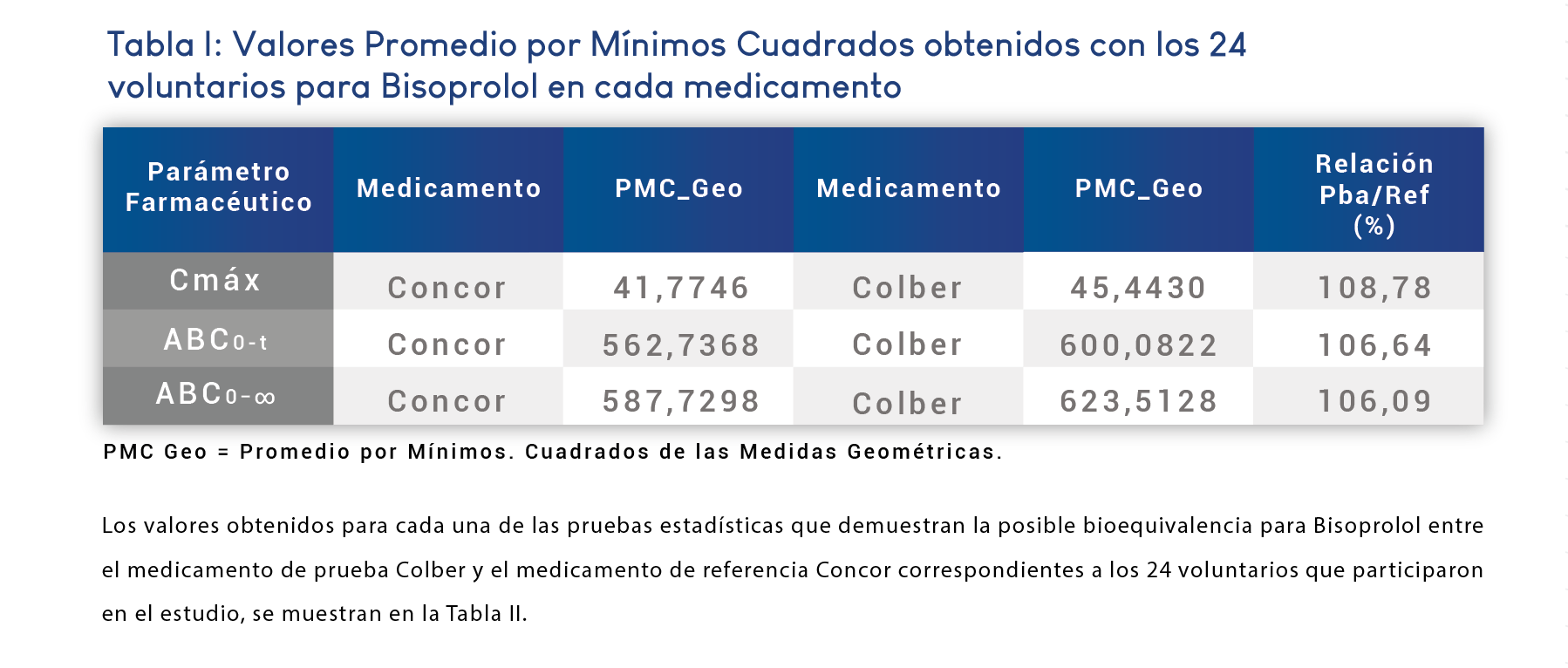

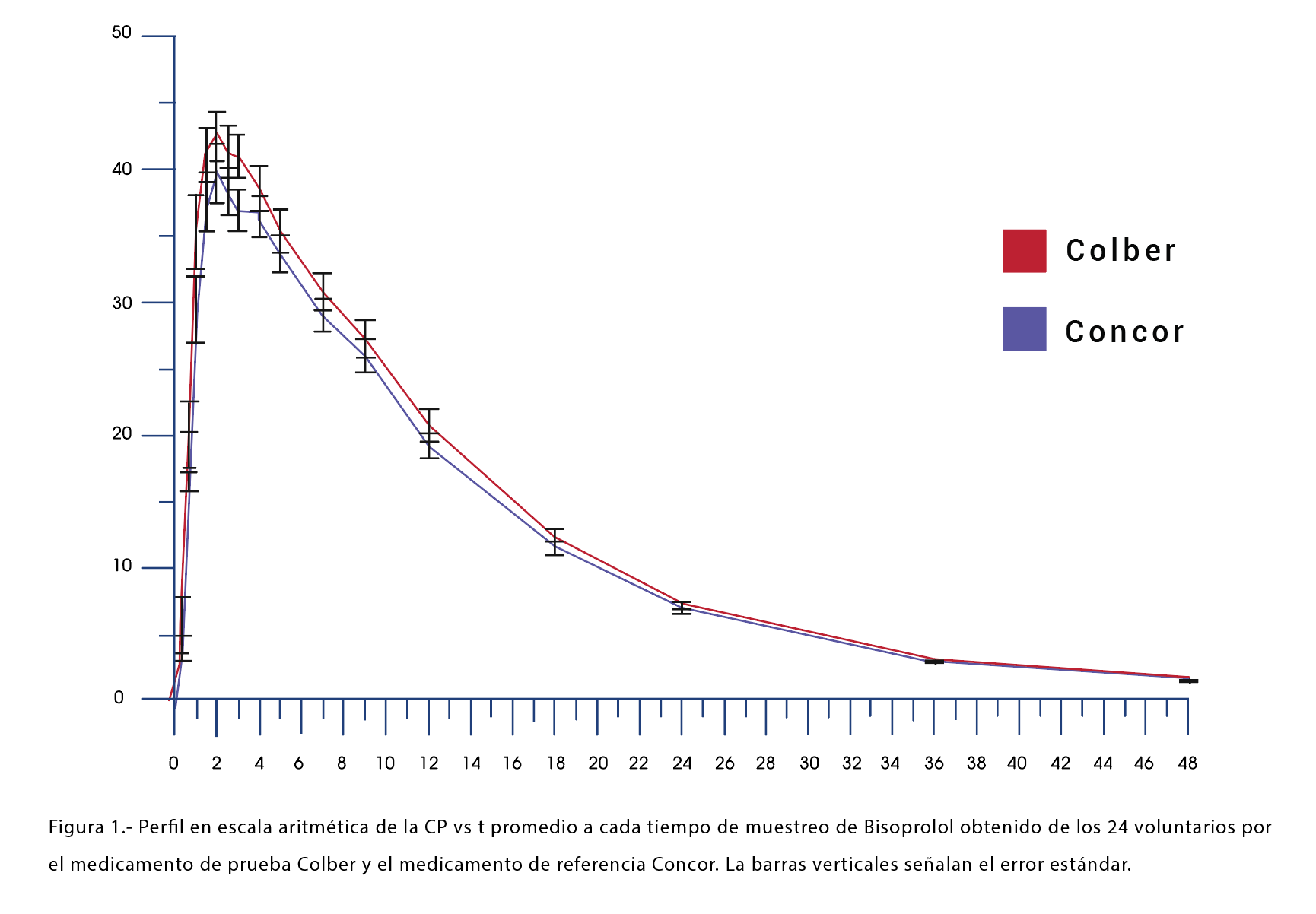
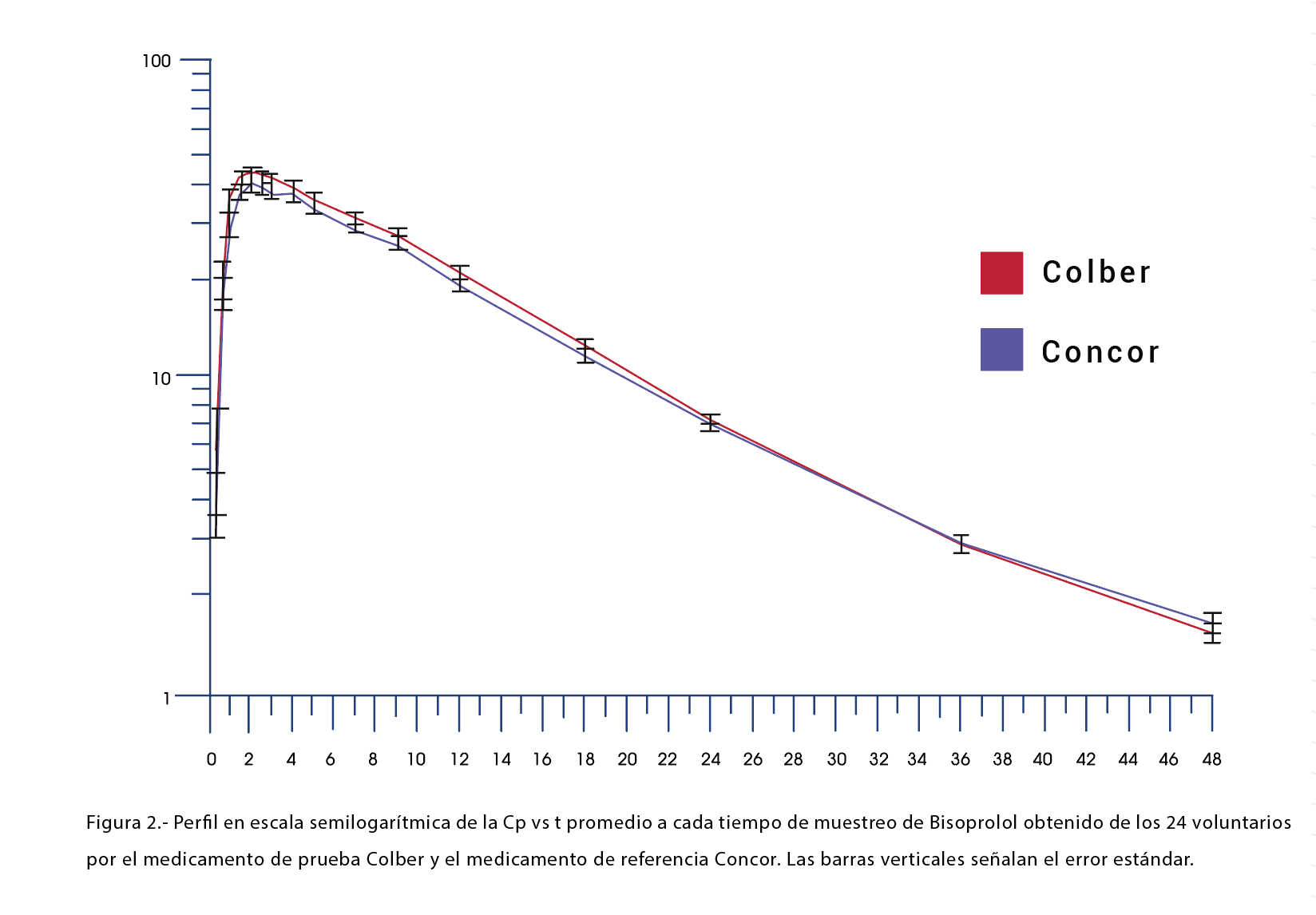
En las Figuras 1 y 2 se muestra el perfil promedio de las Cp vs t obtenido a cada tiempo de muestreo para cada uno de los medicamentos en el estudio de Bioequivalencia de los 24 voluntarios que participaron en el estudio. Cada gráfica se muestra con su respectivo error estándar.
Conclusión
En congruencia a la NOM-177-SSA1-2013 y bajo el Sistema de Calidad de esta Unidad Analítica durante la ejecución de este estudio no se identificó voluntario alguno con comportamiento atípico.
Las pruebas estadísticas demuestran que el medicamento de prueba Colber tabletas es bioequivalente con el medicamento de referencia Concor tabletas al encontrar que el intervalo de confianza de los parámetros farmacocinéticos de Cmáx, ABC0-t y ABC𝟎−∞ se encuentra dentro del 80 y 125 % y las pruebas de probabilidad fueron menores a 0,05 para los datos transformados logarítmicamente de acuerdo a la NOM-177-SSA1-2013.








