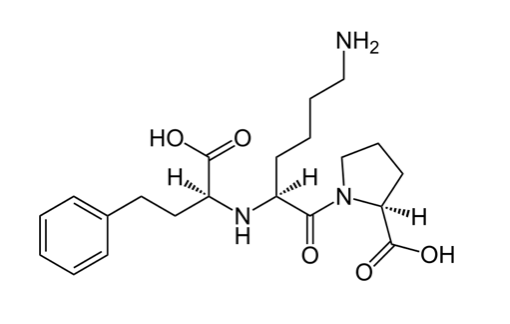
Forma Farmacéutica y Formulación
Forma Farmacéutica
Tabletas
Composición Cualicuantitativa
Cada tableta contiene:
Lisinopril Dihidrato……………………………………………21.78 mg
Equivalente a Lisinopril…………………………………..…20.00 mg
Excipientes csp.
DATOS CLÍNICOS
INDICACIONES TERAPEUTICAS:
- Tratamiento de la hipertensión.
- Tratamiento de la insuficiencia cardiaca sintomática
- Tratamiento a corto plazo (6 semanas) de pacientes hemodinámicamente estables en las 24 horas siguientes a un infarto agudo de miocardio.
- Complicaciones renales de la diabetes mellitus Tratamiento de la enfermedad renal en pacientes hipertensos con diabetes mellitus Tipo 2 y nefropatía incipiente.
POSOLOGIAY FORMA DE ADMINISTRACIÓN:
La dosis de Lisinovum deberá individualizarse según el perfil del paciente. Administrar vía oral y aproximadamente a la misma hora. La toma de alimentos no influye en la absorción de Lisinovum.
CONTRAINDICACIONES:
-
- Hipersensibilidad al principio activo o a alguno de los excipientes.
- Hipersensibilidad a cualquier otro inhibidor del enzima conversor de angiotensina (ECA).
- Antecedentes de angioedema asociado a un tratamiento previo con un inhibidor del ECA.
- Angioedema hereditario o idiopático.
- Segundo o tercer trimestres del embarazo.
- El uso concomitante de lisinopril con medicamentos que contienen aliskirén está contraindicado en pacientes con diabetes mellitus o insuficiencia renal (TFG < 60 ml/min/1,73 m2).
ADVERTENCIAS Y PRECAUCIONES DE EMPLEO:
Hipotensión sintomática
Raramente se ha observado hipotensión sintomática en pacientes hipertensos sin complicaciones. En pacientes hipertensos tratados con lisinopril, la hipotensión es más probable si el paciente ha estado deplecionado de volumen, por ejemplo, por tratamiento diurético, restricción de sal en la dieta, diálisis, diarrea o vómitos, o tiene una hipertensión grave dependiente de la renina. En pacientes con insuficiencia cardíaca, con o sin insuficiencia renal asociada, se ha observado hipotensión sintomática, siendo ésta más probable en aquellos pacientes con grados más graves de insuficiencia cardíaca, reflejado por el empleo de dosis altas de diuréticos del asa, hiponatremia o alteración de la función renal. En pacientes con riesgo alto de hipotensión sintomática, se monitorizarán bajo estrecha supervisión médica el inicio del tratamiento y el ajuste de la dosis. Consideraciones similares son aplicables a pacientes con cardiopatía isquémica o enfermedad cerebrovascular en quienes una disminución excesiva de la presión arterial, podría ocasionar un infarto de miocardio o accidente cerebrovascular.
Si se produjese hipotensión, el paciente deberá ser colocado en decúbito supino y, si es necesario, recibirá una perfusión intravenosa de suero fisiológico. Una respuesta hipotensora transitoria no es una contraindicación para dosis posteriores, que normalmente se pueden administrar sin dificultad, una vez que la presión arterial aumenta tras la expansión de volumen.
En algunos pacientes con insuficiencia cardiaca con presión arterial normal o baja, se puede producir un descenso adicional de la presión arterial sistémica con lisinopril. Este efecto es esperado y habitualmente no es una razón para suspender el tratamiento. Si la hipotensión llega a ser sintomática puede ser necesaria una reducción de la dosis o suspensión de Lisinovum.
Hipotensión en el infarto agudo de miocardio
El tratamiento con Lisinovum no se debe iniciar en pacientes con infarto agudo de miocardio que presenten riesgo de grave deterioro hemodinámico adicional después del tratamiento con un vasodilatador. Estos son pacientes con presión arterial sistólica de 100 mm Hg o menor o en shock cardiogénico. Durante los 3 primeros días después del infarto, la dosis se debe reducir si la presión arterial sistólica es de 120 mm Hg o inferior. Las dosis de mantenimiento se deben reducir a 5 mg o temporalmente a 2,5 mg si dicha presión arterial sistólica es de 100 mm Hg o menor. Si la hipotensión persiste (presión arterial sistólica menor de 90 mm Hg durante más de 1 hora) entonces se deberá suspender el tratamiento con Lisinovum.
Estenosis de las válvulas aórtica y mitral/miocardiopatía hipertrófica
Al igual que el resto de los inhibidores del ECA, lisinopril se debe administrar con precaución en pacientes con estenosis mitral y obstrucción del flujo de salida del ventrículo izquierdo, tal como en la estenosis aórtica o la miocardiopatía hipertrófica.
Alteración de la función renal
En caso de alteración renal (aclaramiento de creatinina < 80 ml/min), se debe ajustar la dosis inicial de Lisinovum de acuerdo al aclaramiento de creatinina del paciente (ver Tabla 1) y posteriormente en función de la respuesta al tratamiento. El control sistemático de las concentraciones sanguíneas de potasio y creatinina forma parte de la práctica médica normal en estos pacientes.
En pacientes con insuficiencia cardiaca, la hipotensión tras el inicio del tratamiento con inhibidores del ECA puede producir una alteración adicional de la función renal. En esta situación se ha notificado insuficiencia renal aguda, habitualmente reversible.
En algunos pacientes con estenosis bilateral de la arteria renal o de la arteria en un riñón único, que han sido tratados con inhibidores del ECA, se han observado incrementos de la concentración sanguínea de urea y creatinina sérica, normalmente reversibles con la suspensión del tratamiento. Esto es especialmente probable en pacientes con insuficiencia renal. Si también estuviera presente hipertensión vasculorrenal, existe un mayor riesgo de hipotensión grave e insuficiencia renal. En estos pacientes, el tratamiento se iniciará bajo estrecho control médico con dosis bajas y cuidadoso ajuste de dosis. Debido a que el tratamiento con diuréticos puede ser un factor contribuyente a lo anteriormente mencionado, se deberá interrumpir su administración y se monitorizará la función renal durante las primeras semanas de tratamiento con Lisinovum.
Algunos pacientes hipertensos, sin aparente enfermedad vasculorrenal pre-existente, han desarrollado incrementos en la concentración sanguínea de urea y creatinina sérica, normalmente leves y transitorios, especialmente cuando Lisinovum se administró concomitantemente con un diurético. Esto es más probable en pacientes con alteración renal pre-existente, pudiendo requerirse la reducción de la dosis y/o suspensión del diurético y/o Lisinovum.
En infarto agudo de miocardio, no se deberá iniciar el tratamiento con Lisinovum en pacientes con evidencia de disfunción renal, definida como una concentración de creatinina sérica superior a 177 micromol/l y/o proteinuria por encima de 500 mg/24 horas. Si se desarrolla disfunción renal durante el tratamiento con lisinopril (concentración de creatinina sérica superior a 265 micromol/l o doble del valor pre-tratamiento) entonces el médico deberá considerar la retirada de Lisinovum.
Hipersensibilidad/Angioedema
Raramente se ha comunicado angioedema en la cara, extremidades, labios, lengua, glotis y/o laringe en pacientes tratados con inhibidores del enzima conversor de angiotensina, incluido lisinopril. Esto puede aparecer en cualquier momento del tratamiento. En estos casos, se debe suspender inmediatamente el tratamiento con Lisinovum y establecer un tratamiento y un control adecuados para asegurar la resolución completa de los síntomas antes de dar de alta a los pacientes. Incluso en los casos en los que se observa únicamente hinchazón de la lengua, sin dificultad respiratoria, los pacientes pueden precisar observación prolongada, ya que el tratamiento con anti-histamínicos y corticoides puede no ser suficiente.
Muy raras veces se han comunicado fallecimientos por angioedema asociado a edema laríngeo o de la lengua. Los pacientes con afectación de la lengua, glotis o laringe son proclives a sufrir obstrucción de la vía respiratoria, sobre todo los que tienen antecedentes de cirugía de las vías respiratorias. En estos casos se debe administrar tratamiento de emergencia inmediatamente. Este tratamiento puede consistir en la administración de adrenalina y/o el mantenimiento de una vía área abierta. El paciente deberá permanecer bajo vigilancia médica estrecha hasta la resolución completa y mantenida de los síntomas.
Los inhibidores del enzima conversor de angiotensina producen una mayor tasa de angioedema en pacientes de raza negra que en el resto de pacientes.
Los pacientes con un historial de angioedema no relacionado con terapia inhibidora del ECA, puede aumentar el riesgo de presencia del angioedema cuando son tratados con un inhibidor de la ECA.
El uso concomitante de IECA con sacubitril/valsartán está contraindicado debido al riesgo elevado de sufrir angioedema. El tratamiento con sacubitril/valsartán no se debe iniciar antes de 36 horas tras la última dosis de Lisinovum. El tratamiento con Lisinovum no se debe iniciar antes de 36 horas tras la última dosis de sacubitril/valsartán.
El uso concomitante de IECA con racecadotrilo, inhibidores de mTOR (por ejemplo, sirolimus, everolimus, temsirolimus) y vildagliptina puede aumentar el riesgo de angioedema (por ejemplo, hinchazón de las vías respiratorias o la lengua, con o sin insuficiencia respiratoria). Se debe tener precaución al iniciar el tratamiento con racecadotril, inhibidores de mTOR (por ejemplo, sirolimus, everolimus, temsirolimus) y vildagliptina en un paciente que ya esté tomando un IECA.
Reacciones anafilactoides en pacientes en hemodiálisis
Se han notificado reacciones anafilactoides en pacientes sometidos a diálisis con membranas de alto flujo (p. ej., AN 69) y tratados concomitantemente con un inhibidor del ECA. En estos pacientes se debe considerar la utilización de un tipo diferente de membrana de diálisis o diferente clase de agente antihipertensivo.
Reacciones anafilactoides durante la aféresis de lipoproteínas de baja densidad (LDL)
En raras ocasiones, los pacientes que reciben inhibidores del ECA durante la aféresis de lipoproteínas de baja densidad (LDL) con sulfato de dextrano han sufrido reacciones anafilactoides con amenaza para la vida. Estas reacciones se evitaron suspendiendo temporalmente el tratamiento inhibidor del ECA antes de cada aféresis.
Desensibilización
Los pacientes que reciben inhibidores del ECA durante el tratamiento de desensibilización (por ej., picadura de los himenópteros) han presentado reacciones anafilactoides mantenidas. En los mismos pacientes, esas reacciones se han evitado cuando los inhibidores del ECA se suspendieron temporalmente, pero reaparecieron con una re-administración inadvertida del medicamento.
Insuficiencia hepática
Muy raramente, los inhibidores del ECA se han asociado con un síndrome que comienza con ictericia colestásica o hepatitis y progresa a necrosis fulminante y (a veces) a la muerte; no obstante el mecanismo de este síndrome no se conoce. Los pacientes que reciben Lisinovum y que desarrollan ictericia o elevaciones marcadas de los enzimas hepáticos deberán suspender el tratamiento con este medicamento y someterse a seguimiento médico adecuado.
Neutropenia/Agranulocitosis
Se ha notificado neutropenia/agranulocitosis, trombocitopenia y anemia en pacientes que reciben inhibidores del ECA. En pacientes con función renal normal y sin otras complicaciones, la neutropenia aparece ocasionalmente. La neutropenia y la agranulocitosis son reversibles tras la suspensión del inhibidor del ECA. Lisinovum se utilizará con gran precaución en pacientes con enfermedad vascular del colágeno, tratamiento inmunosupresor, tratamiento con alopurinol o procainamida o una combinación de estos factores, sobre todo si hay una alteración de la función renal previa. Algunos de estos pacientes desarrollan infecciones graves, que en pocas situaciones no responden al tratamiento antibiótico intensivo. Si se utiliza Lisinovum en estos pacientes, se recomienda controlar de forma periódica los recuentos de leucocitos y se deberá indicar a los pacientes que comuniquen cualquier signo de infección.
Bloqueo dual del sistema renina angiotensina aldosterona (SRAA)
Existe evidencia de que el uso concomitante de inhibidores de la enzima convertidora de angiotensina, antagonistas de los receptores de angiotensina II o aliskirén aumenta el riesgo de hipotensión, hiperpotasemia y disminución de la función renal (incluyendo insuficiencia renal aguda). En consecuencia, no se recomienda el bloqueo dual del SRAA mediante la utilización combinada de inhibidores de la enzima convertidora de angiotensina, antagonistas de los receptores de angiotensina II o aliskirén.
Si se considera imprescindible la terapia de bloqueo dual, ésta sólo se debe llevar a cabo bajo la supervisión de un especialista y sujeta a una monitorización estrecha y frecuente de la función renal, los niveles de electrolitos y la presión arterial.
No se deben utilizar de forma concomitante los inhibidores de la enzima convertidora de angiotensina y los antagonistas de los receptores de angiotensina II en pacientes con nefropatía diabética.
Raza
Los inhibidores del enzima conversor de angiotensina producen una mayor tasa de angioedema en pacientes de raza negra que en el resto de los pacientes.
Al igual que otros inhibidores del ECA, Lisinovum puede ser menos eficaz para disminuir la presión arterial en pacientes de raza negra que en el resto de los pacientes, posiblemente por una mayor prevalencia de estados bajos de renina en la población hipertensa de raza negra.
Tos
Se ha notificado tos con el empleo de inhibidores del ECA. Característicamente, la tos es no productiva, persistente y cesa después de suspender el tratamiento. La tos inducida por los inhibidores del ECA se debe considerar como parte del diagnóstico diferencial de la tos.
Cirugía/Anestesia
En pacientes sometidos a cirugía mayor o durante la anestesia con agentes que producen hipotensión, lisinopril puede bloquear la formación de angiotensina II, secundaria a la liberación compensadora de renina. Si se produce hipotensión y se considera debida a este mecanismo, se puede corregir mediante expansión de volumen.
Potasio en sangre
Los IECA pueden causar hiperpotasemia porque inhiben la liberación de aldosterona. El efecto no suele ser significativo en pacientes con función renal normal. Sin embargo, en pacientes con insuficiencia renal, diabetes mellitus, hipoaldosteronismo y/o en pacientes que toman suplementos de potasio (incluidos los sustitutos de la sal), diuréticos ahorradores de potasio, heparina, trimetoprima o cotrimoxazol, también conocido como trimetoprima/sulfametoxazol y en especial antagonistas de la aldosterona o bloqueadores del receptor de la angiotensina, se puede dar hiperpotasemia. Los diuréticos ahorradores de potasio y los bloqueadores de los receptores de la angiotensina se deben usar con precaución en pacientes que reciben IECA, y se debe controlar la función renal y el potasio en sangre.
La hiperpotasemia puede causar arritmias graves, algunas mortales. Si el uso concomitante de Prinivil y cualquiera de los fármacos mencionados anteriormente se considera necesario, éstos deben utilizarse con precaución y frecuente monitorización del potasio sérico.
Hipoglucemia
Los pacientes diabéticos tratados con antidiabéticos orales o insulina que empiezan a usar un inhibidor de la ECA, deben ser informados de que vigilen estrechamente la hipoglucemia, especialmente durante el primer mes de uso combinado.
Hipercalemia
Se puede producir hipercalemia durante el tratamiento con un inhibidor de ECA. Entre los pacientes con riesgo de desarrollar hipercalemia se encuentran aquellos con insuficiencia renal, diabetes mellitus, hipoaldosteronismo o los que usan de forma concomitante diuréticos ahorradores de potasio, suplementos de potasio o sustitutos de la sal que contengan potasio, o pacientes que reciban otros principios activos asociados con aumentos del potasio sérico (p. ej., heparina y cotrimoxazol, llamado también trimetoprima/sulfametoxazol). Si se considera adecuado el uso concomitante de los agentes mencionados, se recomienda un control periódico. del potasio sérico
Pacientes diabéticos
En pacientes diabéticos tratados con antidiabéticos orales o insulina se debe vigilar estrechamente el control glucémico durante el primer mes de tratamiento con un inhibidor del ECA.
Litio
En general, no se recomienda la combinación de litio y Lisinovum.
INTERACCIÓN CON OTROS MEDICAMENTOS
Otros Agentes antihipertensivos
El uso concomitante de estos agentes puede aumentar los efectos hipotensores de Lisinovum. El uso concomitante con nitroglicerina y otros nitratos, u otros vasodilatadores, puede disminuir aún más la presión arterial.
Los datos de los estudios clínicos han demostrado que el bloqueo dual del sistema renina-angiotensina-aldosterona (SRAA) mediante el uso combinado de inhibidores de la enzima convertidora de angiotensina, antagonistas de los receptores de angiotensina II o aliskirén se asocia con una mayor frecuencia de acontecimientos adversos tales como hipotensión, hiperpotasemia y disminución de la función renal (incluyendo insuficiencia renal aguda) en comparación con el uso de un solo agente con efecto sobre el SRAA.
Diuréticos
Cuando se añade un diurético al tratamiento de un paciente que está recibiendo lisinopril, el efecto antihipertensivo normalmente es adicional.
En los pacientes en tratamiento con diuréticos y especialmente en los que el tratamiento diurético ha sido recientemente instituido, ocasionalmente se puede producir una excesiva reducción de la presión arterial al administrar lisinopril concomitantemente. Se puede minimizar la posibilidad de hipotensión sintomática con Lisinovum suspendiendo el diurético antes de administrar Lisinovum.
Diuréticos ahorradores de potasio, suplementos de potasio o sustitutos de la sal conteniendo potasio
Aunque el potasio en sangre, en general permanece dentro de los límites normales, se puede producir hiperpotasemia en algunos pacientes tratados con Lisinovum.
Los factores de riesgo para el desarrollo de hipercaliemia son: insuficiencia renal, diabetes mellitus y el uso concomitante de diuréticos ahorradores de potasio (ej. espironolactona, eplerenona, triamtereno o amilorida), suplementos de potasio o sustitutos de la sal que contienen potasio. Los diuréticos ahorradores de potasio (por ejemplo, espironolactona, triamtereno o amilorida), suplementos de potasio o sustitutos de sal que contienen potasio pueden dar lugar a aumentos significativos en el potasio en sangre. Además, se debe tener cuidado cuando Lisinovum se administra de forma conjunta con otros medicamentos que aumentan el potasio en sangre, como trimetoprima y cotrimoxazol (trimetoprima/sulfametoxazol), ya que se sabe que trimetoprima actúa como diurético ahorrador de potasio como amilorida. Por lo tanto, no se recomienda la combinación de Lisinovum con los medicamentos mencionados anteriormente. Si el uso concomitante estuviese indicado, se utilizarán con precaución y con controles frecuentes del potasio en sangre.
Si se administra lisinopril con un diurético perdedor de potasio, se puede reducir la hipocaliemia inducida por el diurético.
Litio
Durante la administración concomitante de litio e inhibidores del ECA se ha notificado aumentos reversibles de las concentraciones séricas de litio y toxicidad. La utilización concomitante de diuréticos tiazídicos puede aumentar el riesgo de toxicidad por litio y potenciar la ya aumentada toxicidad del litio con los IECA. No se recomienda la utilización de Lisinovum con litio, pero si se considera necesaria esta combinación se debe realizar un control cuidadoso de los niveles séricos de litio.
Fármacos antiinflamatorios no esteroideos (AINEs), incluido ácido acetilsalicílico ≥ 3 g/día
Los medicamentos antiinflamatorios no esteroideos (AINEs) incluyendo los inhibidores selectivos de la ciclooxigenasa-2 (COX-2) pueden reducir el efecto de los diuréticos y de otros fármacos antihipertensivos. Por tanto, el efecto antihipertensivo de los antagonistas del receptor de la angiotensina II o los inhibidores de la ECA puede ser atenuado por los AINEs, incluyendo los inhibidores selectivos de la COX-2.
La coadministración de los AINEs (incluyendo los inhibidores de la COX-2) y los inhibidores de la ECA tiene un efecto adicional sobre el incremento del potasio sérico y pueden provocar un deterioro de la función renal. Estos efectos generalmente son reversibles. Raramente puede producirse insuficiencia renal aguda, especialmente en pacientes con función renal comprometida, como ancianos o pacientes deshidratados o pacientes que tienen depleción de volumen, incluyendo aquellos en tratamiento con diuréticos. Por tanto, en pacientes con la función renal comprometida, la combinación debe administrarse con precaución.
Antidepresivos tricíclicos (Antipsicóticos/Anestésicos)
El uso concomitante de ciertos medicamentos anestésicos, antidepresivos tricíclicos y antipsicóticos con inhibidores de la ECA puede producir una disminución adicional de la presión arterial.
Simpaticomiméticos
Los simpaticomiméticos pueden reducir los efectos antihipertensivos de los inhibidores de la ECA.
Antidiabéticos
Los estudios epidemiológicos han indicado que la utilización simultánea de inhibidores de la ECA y medicamentos antidiabéticos (insulinas, agentes hipoglucemiantes orales) puede producir un aumento del efecto hipoglucemiante con riesgo de hipoglucemia. Parece que es más probable que este fenómeno ocurra durante las primeras semanas de tratamiento combinado y en pacientes con alteración renal. En pacientes diabéticos tratados con agentes antidiabéticos orales o insulina, deberá vigilarse estrechamente el control glucémico por casos de hipoglucemia, especialmente durante el primer mes de tratamiento con un inhibidor del ECA.
Oro
Raramente se han comunicado reacciones nitritoides (los síntomas incluyen rubor facial, náuseas, vómitos e hipotensión) en pacientes en tratamiento con oro inyectable (aurotiomalato sódico) y tratamiento concomitante con un inhibidor de la ECA, incluyendo Lisinovum.
Inhibidores selectivos de mTOR (p.ej., temsirolimus, sirolimus, everolimus)
Los pacientes en tratamiento concomitante con un inhibidor selectivo de mTOR (ej. temsirolimus, sirolimus, everolimus) pueden estar ante un riesgo mayor de angioedema.
Ciclosporina
Se puede producir hiperpotasemia durante el uso concomitante de IECA con ciclosporina. Se recomienda controlar con frecuencia el potasio en sangre.
Heparina
Se puede producir hiperpotasemia durante el uso concomitante de IECA con heparina. Se recomienda controlar con frecuencia el potasio en sangre.
EMBARAZOY LACTANCIA
Embarazo
No se recomienda el uso de IECA durante el primer trimestre de embarazo. El uso de los IECA está contraindicado durante el segundo y el tercer trimestres del embarazo.
La evidencia epidemiológica con respecto al riesgo de teratogenicidad tras la exposición a los IECA durante el primer trimestre de embarazo no ha sido concluyente. Sin embargo, no se puede descartar un pequeño aumento del riesgo. A menos que se considere esencial el uso continuado de los IECA, las pacientes que estén planeando un embarazo, deben ser cambiadas a un tratamiento antihipertensivo alternativo que tenga un perfil de seguridad establecido para su uso en el embarazo. Cuando se diagnostica un embarazo, el tratamiento con IECA debe ser interrumpido inmediatamente y, si fuera apropiado, debe iniciarse un tratamiento alternativo.
Se sabe que la exposición al tratamiento con un IECA durante el segundo y tercer trimestres induce fetotoxicidad humana (disminución de la función renal, oligohidramnios, retraso de la osificación craneal) y toxicidad neonatal (insuficiencia renal, hipotensión, hipercaliemia).
Si hubiera habido exposición a IECA a partir del segundo trimestre de embarazo, se recomienda realizar un control de la función renal y del cráneo mediante ecografía.
Los niños cuyas madres hayan tomado IECA deberán ser observados estrechamente por si desarrollan hipotensión.
Lactancia
Debido a que no hay información disponible sobre el uso de Lisinovum durante la lactancia, no se recomienda el uso de Lisinovum, siendo preferibles otros tratamientos con perfiles de seguridad mejor establecidos, especialmente cuando se dé el pecho un recién nacido o prematuro.
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR Y MANEJAR MAQUINARIA
Cuando se conduzcan vehículos o se utilicen máquinas, deberá tenerse en cuenta que puede aparecer ocasionalmente sensación de mareo o cansancio.
REACCIONES ADVERSAS:
No se han observado diferencias en el perfil de seguridad de pacientes pediátricos y adultos.
Durante el tratamiento con Lisinovum y otros inhibidores de la IECA se han observado y notificado las siguientes reacciones adversas con las frecuencias indicadas a continuación: Muy frecuentes (≥ 1/10), frecuentes (≥ 1/100 a <1/10), poco frecuentes (≥1/1.000 a < 1/100), raras (≥1/10.000 a < 1/1000), muy raras (<1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
Trastornos de la sangre y del sistema linfático:
Raros: disminución de la hemoglobina, disminución del hematocrito,
Muy raros: depresión de la médula ósea, anemia, trombocitopenia, leucopenia, neutropenia, agranulocitosis, anemia hemolítica, linfadenopatía, enfermedad autoinmune.
Trastornos del metabolismo y de la nutrición:
Muy raros: hipoglucemia.
Trastornos del sistema nervioso
Frecuentes: mareo, cefalea,
Poco frecuentes: parestesia, vértigo, alteraciones del Sentido del gusto, trastornos
Trastornos psiquiátricos
Poco frecuentes: alteración del estado de ánimo
Raros: confusión mental
Trastornos oculares:
Raros: trastorno del campo visual
Trastornos cardiacos:
Poco frecuentes: infarto de miocardio o accidente cerebrovascular, posiblemente secundario a una hipotensión excesiva en pacientes de alto riesgo
palpitaciones, taquicardia.
Raro shock cardiogénico.
Trastornos vasculares
Frecuentes: efectos ortostáticos (incluida hipotensión)
Poco frecuentes: fenómeno de Raynaud.
Trastornos respiratorios, torácicos y mediastínicos:
Frecuentes: tos,
Muy raros: bronquitis crónica, broncoespasmo, alveolitis alérgica/neumonía eosinofílica.
Trastornos gastrointestinales:
Frecuentes: diarrea
Poco frecuentes: náuseas, dolor abdominal
Raros: sequedad de boca, trastornos de la lengua
Muy raros: angioedema intestinal
Trastornos hepatobiliares:
Muy raros: pancreatitis, hepatitis (hepatocelular o colestásica), ictericia
Trastornos de la piel y del tejido subcutáneo:
Poco frecuentes: erupción, prurito
Raros: Hipersensibilidad/edema angioneurótico: edema angioneurótico de la cara, extremidades, labios, lengua, glotis y/o laringe, urticaria, alopecia, psoriasis.
Muy raros: diaforesis.
Trastornos renales y urinarios:
Frecuentes: disfunción renal,
Raros: uremia, insuficiencia renal aguda
Muy raros: oliguria/anuria.
Trastornos endocrinos:
Raros: síndrome de secreción inadecuada de hormona antidiurética (SSIHA).
Trastornos del aparato reproductor y de la mama:
Poco frecuentes: impotencia,
Raros: ginecomastia.
Trastornos generales y alteraciones en el lugar de administración:
Poco frecuentes: fatiga, astenia.
Exploraciones complementarias
Poco frecuentes: aumento de la urea sanguínea, aumento de la creatinina sérica, aumento de los enzimas hepáticos, hiperpotasemia,
Raros: aumento de la bilirrubina sérica, hiponatremia.
Se ha comunicado un complejo sintomático que puede incluir una o más de las siguientes situaciones: se puede producir fiebre, vasculitis, mialgia, artralgia/artritis, anticuerpos antinucleares (ANA) positivos, velocidad de sedimentación globular (VSG) elevada, eosinofilia y leucocitosis, erupción cutánea, fotosensibilidad u otras manifestaciones dermatológicas.
Reacciones adversas de relación causal o desconocida
Trastornos de la sangre y del sistema linfático:
Muy raros: anemia hemolítica.
Trastornos del metabolismo y de la nutrición:
Frecuencia no conocida: gota.
Trastornos psiquiátricos:
Poco frecuentes: trastornos del sueño (insomnio y somnolencia)
Frecuencia no conocida: disminución de la libido, depresión.
Trastornos del sistema nervioso:
Poco frecuentes: vértigo, alteraciones del sentido del gusto.
Trastornos oculares:
Frecuencia no conocida: visión borrosa.
Trastornos cardíacos:
Frecuencia no conocida: angina de pecho y alteraciones del ritmo.
Trastornos vasculares:
Frecuencia no conocida: ictus (accidente cerebrovascular).
Trastornos respiratorios, torácicos y mediastínicos:
Poco frecuentes: rinitis
Muy raros: sinusitis
Frecuencia no conocida: bronquitis, disnea, congestión nasal, dolor faríngeo, síntomas del sistema respiratorio superior.
Trastornos gastrointestinales:
Frecuentes: vómitos
Poco frecuentes: indigestión
Frecuencia no conocida: anorexia, estreñimiento, flatulencia.
Trastornos hepatobiliares:
Frecuencia no conocida: insuficiencia hepática.
Trastornos de la piel y del tejido subcutáneo:
Muy raros: pénfigo, necrólisis epidérmica tóxica, síndrome de Stevens-Johnson, eritema multiforme, pseudolinfoma cutáneo.
Trastornos musculoesqueléticos y del tejido conjuntivo:
Frecuencia no conocida: dolor lumbar, dolor de las articulaciones, calambres musculares y dolor de hombros.
Trastornos renales y urinarios:
Frecuencia no conocida: infección del tracto urinario.
Trastornos generales y alteraciones en el lugar de administración:
Frecuencia no conocida: dolor de pecho, rubor y síncope.
Pacientes pediátricos
Los datos de seguridad de estudios clínicos sugieren que Lisinovum, por lo general, es bien tolerado en pacientes pediátricos hipertensos y que el perfil de seguridad en este grupo de edad es comparable al observado en adultos.
SOBREDOCIFICACIÓN:
En humanos se dispone de datos limitados de sobredosis. Los síntomas asociados a sobredosis de los inhibidores del ECA pueden ser hipotensión, shock circulatorio, alteraciones electrolíticas, insuficiencia renal, hiperventilación, taquicardia, palpitaciones, bradicardia, mareo, ansiedad y tos.
El tratamiento recomendado de la sobredosis es la perfusión intravenosa de suero fisiológico. Si se produce hipotensión, deberá colocarse al paciente en posición de shock. En caso de estar disponible, también puede considerarse el tratamiento con una perfusión de angiotensina II y/o catecolaminas intravenosas. Si la administración es reciente, se tomarán medidas para eliminar lisinopril (p. ej., inducción de vómito, lavado gástrico, administración de absorbentes y sulfato sódico). Puede retirarse lisinopril de la circulación general mediante hemodiálisis. En caso de bradicardia resistente al tratamiento está indicado la utilización de un marcapasos. Deberán controlarse con frecuencia las constantes vitales y las concentraciones séricas de electrólitos y creatinina.
PROPIEDADES FARMACOLÓGICAS
Propiedades Farmacodinámicas:
Grupo fármaco terapéutico: Inhibidores del enzima conversor de angiotensina, Código ATC: C09A A03.
Lisinovum es un inhibidor de la peptidil dipeptidasa, el cual inhibe el enzima conversor de angiotensina (ECA) que cataliza la conversión de angiotensina I al péptido vasoconstrictor angiotensina II. Angiotensina II también estimula la secreción de aldosterona por la corteza suprarrenal. La inhibición del ECA da lugar a concentraciones reducidas de angiotensina II, que conduce a una disminución de la actividad vasopresora y a una secreción reducida de aldosterona; ésta última puede ocasionar un aumento en la concentración de potasio sérico.
Aunque se cree que el mecanismo a través del cual lisinopril disminuye la presión arterial se debe principalmente a la inhibición del sistema renina-angiotensina-aldosterona, lisinopril ha mostrado tener acción antihipertensiva incluso en pacientes hipertensos con bajos niveles de renina. El ECA es idéntico a la quinasa II, enzima que degrada la bradiquinina. Todavía no se ha dilucidado si los niveles elevados de bradiquinina, un potente péptido vasodilatador, juegan un papel en los efectos terapéuticos de Lisinovum.
Propiedades Farmacocinéticas:
Lisinovum es un inhibidor del ECA no sulfidrílico activo por vía oral.
Absorción
Tras la administración oral de lisinopril, las concentraciones séricas máximas se presentan en alrededor de 7 horas, aunque hubo una tendencia a un pequeño retraso en la consecución de estas concentraciones séricas máximas en pacientes con infarto agudo de miocardio. Según la recuperación urinaria, la absorción media de lisinopril es del 25 %, con una variabilidad interpacientes del 6-60 % en el intervalo de dosis estudiado (5-80 mg). En los pacientes con insuficiencia cardiaca, la biodisponibilidad absoluta se reduce aproximadamente un 16 %. La absorción de Lisinovum no se altera en presencia de alimentos.
Distribución
Lisinovum no parece unirse a proteínas séricas diferentes del enzima conversor de angiotensina (ECA). Los estudios en ratas indican que lisinopril apenas atraviesa la barrera hematoencefálica.
Eliminación
Lisinovum no sufre metabolismo, y se excreta sin cambios en la orina. Tras la administración múltiple, lisinopril presenta una semivida de acumulación eficaz de 12,6 horas. El aclaramiento de lisinopril en pacientes sanos es aproximadamente de 50 ml/min. La disminución de las concentraciones séricas muestra una fase terminal prolongada, que no contribuye a la acumulación del fármaco. Esta fase terminal probablemente representa una unión saturable al ECA y no es proporcional a la dosis.
Alteración hepática
La alteración hepática en pacientes cirróticos produjo una disminución de la absorción de lisinopril (alrededor de un 30 %, determinado mediante recuperación urinaria) y un aumento en la exposición (alrededor de un 50 %) en comparación con personas sanas debido a una disminución del aclaramiento.
Alteración de la función renal
La alteración de la función renal disminuye la eliminación de Lisinovum, que se excreta a través de los riñones, aunque esta disminución sólo comienza a ser clínicamente importante cuando la tasa de filtración glomerular es inferior a 30 ml/min. En la alteración de la función renal leve a moderada (aclaramiento de creatinina 30-80 ml/min), el ABC medio aumentó únicamente en un 13%, mientras que en la alteración de la función renal grave (aclaramiento de creatinina 5-30 ml/min) este valor se incrementó de 4 a 5 veces. Lisinovum puede eliminarse mediante diálisis. Durante 4 horas de hemodiálisis, las concentraciones plasmáticas de lisinopril disminuyeron un promedio del 60 %, con un aclaramiento por diálisis de entre 40 y 55 ml/min.
Insuficiencia cardiaca
Los pacientes con insuficiencia cardiaca presentan una exposición mayor a lisinopril en comparación con personas sanas (aumento promedio del ABC del 125 %), aunque según la recuperación urinaria de lisinopril, existe una disminución de la absorción de alrededor del 16 % en comparación con dicho grupo de personas sanas.
Población pediátrica
El perfil farmacocinético de Lisinovum se estudió en 29 pacientes pediátricos hipertensos, de edades comprendidas entre los 6 y 16 años de edad, con un GFR superior a 30 ml/min/1,73 m2. Después de administrar dosis de 0,1 a 0,2 mg/kg, las concentraciones plasmáticas máximas en estado de equilibrio de lisinopril se dieron en un periodo de 6 horas, y la extensión de la absorción, basada en la recuperación urinaria, fue aproximadamente del 28%. Estos valores fueron similares a los obtenidos previamente en adultos.
Los valores de ABC y Cmax en niños en este estudio fueron coherentes con los observados en adultos.
Personas de edad avanzada
Los pacientes ancianos tienen concentraciones sanguíneas mayores y valores superiores del área bajo la curva de la concentración de plasma frente al tiempo (aumento de alrededor del 60 %) en comparación con las personas jóvenes.
DATOS FARMACÉUTICOS
LISTA DE EXCIPIENTES:
Celulosa Microcristalina, manitol, Laurilsulfato de sodio, Croscarmelosa Sódica, dióxido de silicio, Fosfato dibásico de Calcio Dihidrato, almidón de maíz pregelatinizado, Estearato de Magnesio.
INCOPATIBILIDADES:
No procede
PERIODODE VALIDEZ:
3 años.
PRECAUCIONES ESPECIALES DE COSERVACIÓN:
Almacenar a temperatura no mayor de 30°C.
NATURALEZA Y CONTENIDO DEL ENVASE:
Blíster PVC 250 / PVDC 40 incoloro de 210mm. Aluminio 210mm, impreso con tinta color morado.
Muestra Médica: Caja con 2 tabletas
Comercial: Caja con 30 y 100 tabletas + inserto
FECHA DE REVISIÓN DEL TEXTO
Mayo-2021.
REFERENCIAS BIBLIOGRAFICAS
Agencia Española de Medicamentos y Productos Sanitarios – AEMPS- (2020). Ficha técnica Lisinopril Dihidrato. Información disponible en https://cima.aemps.es/cima/pdfs/es/ft/59129/FT_59129.pdf
Agencia Española de Medicamentos y Productos Sanitarios – AEMPS- (2020). Ficha técnica Lisinopril. Información disponible en: https://cima.aemps.es/cima/pdfs/es/p/66465/66465_p.pdf