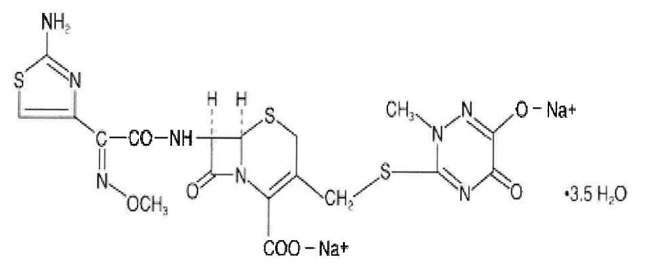
Forma Farmacéutica y Formulación
Forma Farmacéutica
axtar® IM Polvo estéril para inyección ADMINISTRACIÓN INTRAMUSCULAR
Presentación
Cada frasco vial contiene: Ceftriaxona sódica equivalente a Ceftriaxona…0.5 g
Cada frasco vial contiene: Ceftriaxona sódica equivalente a Ceftriaxona…1,0 g
Solvente para vía IM
Cada ampolla contiene: Agua estéril para inyección con lidocaína 1%…2.0 mL *
Cada ampolla contiene: Agua estéril para inyección con lidocaína 1%…3.5 mL *
axtar® IV Polvo estéril para inyección ADMINISTRACIÓN INTRAVENOSA
Presentación
Cada frasco vial contiene: Ceftriaxona sódica equivalente a Ceftriaxona…0.5 g
Cada frasco vial contiene: Ceftriaxona sódica equivalente a Ceftriaxona…1,0 g
Solvente para vía IV
Cada ampolla contiene: Agua estéril para inyección…5 mL *
Cada ampolla contiene: Agua estéril para inyección…10 mL *
*El volumen de solvente necesario para reconstituir el principio activo.
PROPIEDADES FARMACOLÓGICAS
a. PROPIEDADES FARMACODINAMICAS:
Grupo farmacoterapéutico: Cefalosporinas de tercera generación. Ceftriaxona es una cefalosporina de amplio espectro y acción prolongada para uso parenteral. Su actividad bactericida se debe a la inhibición de la síntesis de la pared celular.
- RESISTENCIA:
Ceftriaxona puede ser activa contra organismos productores de algunos tipos de beta- lactamasa, por ejemplo TEM-1. Sin embargo, existen beta-lactamasas que hidrolizan cefalosporinas y que pueden inactivar a la ceftriaxona como es el caso de las beta- lactamasas de espectro extendido presentes en algunas especies como Klebsiella spp. y Escherichia coli, por lo que a pesar de su aparente sensibilidad in vitro, deben considerarse resistentes desde un punto de vista clínico. Así mismo, algunas cepas de Enterobacter spp., Citrobacter freundii, Morganella spp., Serratia spp. y Providencia spp. producen cefalosporinasas cromosómicas inducibles, tipo AmpC. La inducción o desrepresión estable de estas beta-lactamasas cromosómicas antes o durante la exposición a cefalosporinas produce resistencia frente a todas las cefalosporinas.
Ceftriaxona no es activa contra la mayoría de bacterias que presentan proteínas de unión a penicilinas con una afinidad reducida por los fármacos beta-lactámicos, como es el caso de Streptococcus pneumoniae resistente a penicilina. La resistencia también
puede deberse a impermeabilidad bacteriana o la presencia de bombas de expulsión. En el mismo microorganismo puede hallarse presente más de una de estas cuatro formas de resistencia.
- PUNTOS DE CORTE
EUCAST (European Committee on Antimicrobial Susceptibility Testing versión 6.0 2016- 01-01) puntos de corte:
| Microorganismo | Sensibilidad | Resistencia |
| Enterobacteriaceae | <1 | >2 |
| Streptococcus pneumoniae | ≤ 0.5 | >2 |
| Viridans group streptococci | ≤ 0.5 | >0.5 |
| Haemophilus influenzae | ≤ 0.125 | >0.125 |
| Moraxella catarrhalis | ≤ 1 | >2 |
| Neisseria gonorrhoeae | ≤ 0.125 | >0.125 |
| Neisseria meningitidis | ≤ 0.125 | >0.125 |
La prevalencia de resistencias puede variar geográficamente y con el tiempo para las especies seleccionadas y es conveniente disponer de información local sobre resistencias, especialmente cuando se trata de infecciones graves. Deberá consultarse con un experto según se requiera cuando la prevalencia de resistencias es tal que la utilidad del agente en al menos algunos tipos de infecciones sea cuestionable. La información siguiente sólo proporciona una idea aproximada de la probabilidad que el microorganismo sea sensible a ceftriaxona.
-Microorganismos frecuentemente sensibles:
Gram-positivos aerobios: Staphylococcus spp.coagulasa negativo Staphylococcus aureus*, Streptococcus spp., Streptococcus pyogenes*, Estreptococos del grupo B (incluido S.agalactiae), Streptococcus pneumoniae*, Streptococcus viridans
Gram-negativos aerobios: Citrobacter spp., Citrobacter diversus, Citrobacter freundii, Escherichia coli*, Haemophilus influenzae*, Haemophilus parainfluenzae*, Klebsiella spp., Klebsiella pneumoniae*, Klebsiella oxytoca*, Moraxella catarrhalis*, Morganella morganii, Neisseria gonorrhoeae*, Neisseria meningitidis*, Proteus mirabilis*, Proteus vulgaris*, Providencia spp., Salmonella spp., Serratia spp., Serratia marcescens, Shigella spp., Borrelia burgdoferi
-Microorganismos para los que la resistencia adquirida puede ser un problema
Aerobios Gram-positivos: Staphylococcus epidermidis*
Aerobios Gram-negativos: Enterobacter spp., Enterobacter aerogenes*, Enterobacter cloacae*
– Microorganismos Resistentes:
Aerobios Gram-positivos: Enterococcus spp., Enterococcus faecalis, Enterococcus faecium, Listeria monocytogenes, Staphylococcus spp.meticilín resistentes, Staphylococcus aureus meticilín resistente.
Aerobios Gram-negativos: Aeromonas spp., Achromobacter spp., Acinetobacter spp., Alcaligenes spp., Flavobacterium spp., Pseudomonas spp., Pseudomonas aeruginosa. Anaerobios: Bacteroides fragilis, Bacteroides spp.
Otros: Chlamydia, Mycobacteria, Mycoplama, Rickettsia spp.
*Se ha demostrado eficacia clínica para aislados sensibles en indicaciones clínicas aprobadas.
b. PROPIEDADES FARMACOCINÉTICAS:
Ceftriaxona presenta una farmacocinética no lineal dosis-dependiente para todos los parámetros farmacocinéticas básicos, con excepción de la semivida de eliminación.
Absorción:
La concentración plasmática máxima tras una dosis única intramuscular de 1 g es alrededor de 81 mg/l y se alcanza en 2-3 horas tras su administración. El área bajo la curva “concentración en plasma tiempo”, tras la administración intramuscular, es equivalente a la administración intravenosa de una dosis equivalente, indicando que la biodisponibilidad de la ceftriaxona administrada intramuscular es del 100%.
Distribución y biotransformación:
El volumen de distribución de la ceftriaxona es de 7-12 L distribuyéndose a numerosos tejidos y fluidos corporales. Tras una dosis de 1-2 g intravenosa se pueden encontrar concentraciones superiores a la concentración mínima inhibitoria para la mayoría de los patógenos responsables de infecciones en más de 60 tejidos y fluidos corporales, incluyendo pulmón, corazón, tractos biliar y hepático, amígdala, oído medio y mucosa nasal, hueso y fluidos cerebroespinal, pleural prostático y sinovial.
Ceftriaxona penetra en las meninges inflamadas de recién nacidos, lactantes y niños. Las concentraciones de ceftriaxona en LCR son > 1,4 mg/l, 24 horas después de la administración de ceftriaxona por vía intravenosa en dosis de 50-100 mg/Kg (recién nacidos y lactantes respectivamente). La concentración máxima en LCR se alcanza a las 4 horas tras la inyección intravenosa, obteniéndose un valor medio de 18 mg/l. En la meningitis bacteriana, la difusión media en el LCR es del 17% con respecto a la concentración plasmática, mientras que es del 4% en pacientes con meningitis aséptica.
En los pacientes adultos con meningitis la inyección de 50 mg/Kg permite, entre las 2 y
24 horas, alcanzar concentraciones en LCR varias veces superiores a las concentraciones inhibitorias mínimas necesarias para la mayoría de los gérmenes causantes de meningitis. Ceftriaxona atraviesa la barrera placentaria y se excreta en la leche materna a bajas concentraciones.
Unión a proteínas:
Ceftriaxona se une a la albúmina plasmática de forma reversible y dicha unión decrece con el aumento de concentración. Así una unión del 95% a concentraciones plasmáticas < 100 mg/l llega al 85% a la concentración de 300 mg/l. Debido al menor contenido de albúmina en el líquido intersticial, la proporción de ceftriaxona libre en éste es mayor que en plasma.
Metabolismo:
Ceftriaxona no se metaboliza sistemáticamente, únicamente la flora intestinal la transforma en metabolitos inactivos.
Eliminación:
El aclaramiento plasmático total es de 10-22 ml/min. El 50-60% de ceftriaxona se excreta inalterada en la orina en tanto que el 40-50% es excretada por la bilis, también en forma inalterada. La vida media de eliminación en los adultos es de aproximadamente 8 horas.
Poblaciones especiales:
En la primera semana de vida, el 80% de la dosis es excretada por la orina; alrededor del primer mes, esto baja a niveles similares a los de adultos. En niños de menos de 8 días de edad y en pacientes de edad avanzada mayores de 75 años, el promedio de la semivida de eliminación es normalmente de dos a tres veces mayor que la de adultos jóvenes.
En pacientes con disfunción renal o hepática, la farmacocinética de ceftriaxona se altera sólo mínimamente y la vida media de eliminación aumenta de forma muy ligera; si sólo la función renal está alterada, aumenta la eliminación por bilis y, si la alterada es sólo la función hepática, aumenta entonces la eliminación renal.
DATOS CLÍNICOS
a. INDICACIONES TERAPÉUTICAS
Ceftriaxona está indicada en el tratamiento de infecciones graves causadas por microorganismos sensibles a ceftriaxona:
- Meningitis bacteriana
- Infecciones abdominales, tales como peritonitis e infecciones del tracto biliar
- Infecciones osteoarticulares
- Infecciones complicadas de piel y tejidos blandos
- Infecciones complicadas del tracto urinario (incluyendo pielonefritis)
- Infecciones del tracto respiratorio
- Infecciones del tracto genital (incluyendo la enfermedad gonocócica)
- Estadios II y III de la enfermedad de Lyme
- Tratamiento de pacientes con bacteriemia que ocurre en asociación con, o se sospecha que está asociada con, cualquiera de las infecciones mencionadas anteriormente.
Profilaxis de infecciones post-operatorias, en cirugía contaminada o potencialmente contaminada, fundamentalmente cirugía cardiovascular, procedimientos urológicos y cirugía colorrectal. Se deben tener en cuenta las recomendaciones oficiales sobre el uso adecuado de agentes antibacterianos.
b. POSOLOGÍA Y FORMA DE ADMINISTRACIÓN:
La dosis seleccionada para tratar una infección individual debe tener en cuenta, los microorganismos y la sensibilidad al agente antibacteriano, la gravedad y lugar de la infección y la edad y peso del paciente. la duración del tratamiento varía en función de la gravedad de la infección y de la respuesta del paciente, y deberá ser, en general, lo más corta posible. En general, la administración de ceftriaxona se mantendrá durante un mínimo de 48 a 72 horas tras la mejoría del cuadro clínico, o hasta obtener la erradicación microbiológica.
Adultos y niños mayores de 12 años y niños de ≥ 50 kg:
La dosis usual es 1-2 g de ceftriaxona administrados una sola vez al día (cada 24 horas). En casos graves o en infecciones causadas por microorganismos moderadamente sensibles, la dosis puede incrementarse hasta un máximo de 4 g una sola vez al día.
- Estadíos II y III de la enfermedad de Lyme
Se recomienda administrar una dosis de 50 mg/kg de peso hasta un máximo de 2 gramos diarios una vez al día durante 14 días.
- Profilaxis perioperatoria
Una única dosis de 1-2 g, 30-90 minutos antes de la intervención. En cirugía colorrectal se debe asociar otro antibiótico de espectro adecuado frente a anaerobios.
- Terapia combinada:
En infecciones causadas por gérmenes Gram-negativos puede ser necesaria la asociación con aminoglucósidos, sobre todo si se trata de infecciones graves o que supongan una amenaza para la vida.
- Pacientes con alteración renal
En caso de pacientes con función renal alterada, no es preciso reducir la dosis siempre que la función hepática permanezca normal. Sólo en casos de aclaración de creatinina < 10 ml/min., la dosis de ceftriaxona no deberá exceder de los 2 g diarios.
En pacientes dializados no es preciso administrar una dosis adicional suplementaria tras la sesión de diálisis; en cualquier caso, se controlará la situación clínica del paciente por si fuesen necesarios ajustes de la dosis.
- Pacientes con alteración hepática
En caso de alteración de la función hepática, no es necesario reducir la dosis si la función renal está intacta. En caso de disfunción renal y hepática graves, la dosis de ceftriaxona no deberá exceder de los 2 g diarios a no ser que se determinarán a intervalos regulares las concentraciones plasmáticas y se ajustará la dosis en caso necesario.
- Pacientes de edad avanzada
No se requiere modificar las dosis recomendadas para los adultos siempre que no exista deterioro de la función renal y/o hepática.
- Población pediátrica
Neonatos (hasta 14 días): 20 a 50 mg/kg de peso, administrados en una única dosis, sin que existan diferencias entre los nacidos a término y los prematuros. No se debe exceder la dosis de 50 mg/kg de peso.
Neonatos (15-28 días), lactantes (de 28 días a 23 meses) y niños (de 2 a 11 años): dosis única diaria de 20-80 mg/kg de peso.
Meningitis bacteriana en neonatos (15-28 días), lactantes (de 28 días a 23 meses) y niños (de 2 a 11 años): Se iniciará el tratamiento con dosis de 100 mg/kg (sin exceder los 4 g) una vez al día. Tan pronto como se identifique el germen causal y se determine su sensibilidad se podría ajustar consecuentemente la dosis.
FORMA DE ADMINISTRACIÓN:
Deben ser reconstituidas antes de su uso: agitar el frasco para desprender el polvo y reconstituir con la cantidad y tipo de solvente indicado en la tabla “NOMBRE, FORMULA Y PRESENTACIÓN”, agitar bien.
Axtar® IM: Intramuscular Axtar® IV: Intravenosa
Las soluciones que contiene calcio, (por Ej. solución Ringer o solución Hartmann), no se deben utilizar para reconstituir los viales de ceftriaxona ni para diluir un vial reconstituido cuando la administración sea IV ya que pueden formarse precipitados. Se pueden producir también precipitados de ceftriaxona-calcio cuando la ceftriaxona se mezcla con las soluciones que contienen calcio en la misma línea de la administración IV. Por lo tanto, la ceftriaxona y las soluciones que contienen calcio no deben mezclarse ni administrase simultáneamente.
- Solo para IM: La administración en inyección intramuscular se realizará en un músculo relativamente grande. Se recomienda no inyectar más de 1 g en el mismo
- Solo para IV: La administración de la inyección intravenosa directa se realizará en 2-4 minutos. La administración de dosis superiores a 50 mg/kg deberá realizarse mediante perfusión.
c. CONTRAINDICACIONES:
Está contraindicada en:
- Recién nacidos prematuros hasta la edad corregida de 41 semanas (semanas de gestación + semanas de vida)
- Recién nacidos a término (hasta 28 días de edad) con:
- Ictericia, o aquellos con hipoalbuminemia o acidosis, ya que con estas condiciones la unión de bilirrubina es probable que esté
- Si se necesita (o se considera que se va a necesitar) tratamiento con calcio IV, o perfusiones que contengan calcio debido al riesgo de precipitación de la ceftriaxona con
Está contraindicada en pacientes con hipersensibilidad al principio activo o alguno de los excipientes o a otras cefalosporinas. Así mismo, está contraindicado en pacientes con hipersensibilidad inmediata o grave a las penicilinas o a cualquier otro antibiótico beta-lactámico.
El uso concomitante de ceftriaxona y productos intravenosos que contienen calcio está contraindicado en recién nacidos (≤28 días de edad). Ceftriaxona no debe ser usado en recién nacidos (≤28 días de edad) si está recibiendo (o se espera que reciba) productos intravenosos que contengan calcio.
En los pacientes de >28 días de edad, ceftriaxona y productos que contengan calcio pueden administrarse secuencialmente, siempre y cuando las líneas de infusión, entre infusiones, se laven a fondo con un líquido compatible.
Ceftriaxona no debe ser administrada simultáneamente con soluciones intravenosas que contengan calcio, a través de un sistema en Y en ningún grupo de edad.
d. ADVERTENCIAS Y PRECAUCIONES ESPECIALES DE EMPLEO:
Antes de iniciar el tratamiento con ceftriaxona debe investigarse la posible existencia de antecedentes de hipersensibilidad a cefalosporinas y penicilinas. En enfermos hipersensibles a penicilinas debe tenerse en cuenta la posibilidad de reacciones alérgicas cruzadas.
Se han observado reacciones de hipersensibilidad graves y en ocasiones mortales (anafilaxia) en pacientes tratados con antibióticos beta-lactámicos. Si ocurriera una reacción alérgica se interrumpirá el tratamiento con este medicamento y se instaurará un tratamiento de soporte.
El uso de antibióticos, entre ellos la ceftriaxona, puede producir alteración en la flora normal del colon con sobrecrecimiento de Clostridium difficile, cuya toxina puede desencadenar un cuadro de colitis psedomembranosa que cursa con fiebre, dolor abdominal y diarrea que puede ser sanguinolenta. Su aparición puede ocurrir durante el tratamiento o semanas después de finalizado el mismo. Los casos leves responden normalmente a la supresión del tratamiento, pero los casos moderados a graves pueden precisar además de un tratamiento de reposición hidroeléctrica y de un antibiótico efectivo frente a C. difficile.
Los anticolinérgicos y antiperistálticos pueden agravar el estado del paciente.
Como ocurre con los agentes antibacterianos, el uso prolongado de ceftriaxona puede dar lugar a sobreinfecciones causadas por microorganismos resistentes.
La administración de dosis de ceftriaxona generalmente superiores a la recomendada, la duración del tratamiento superior a 14 días, la presencia de deshidratación o de fallo renal pueden dar lugar a precipitados de ceftriaxona cálcica en la vesícula biliar que en la ecografía puede ser interpretada como una litiasis biliar y que, habitualmente suelen desaparecer una vez concluido el tratamiento o tras la retirada el fármaco. En raras ocasiones se han asociado estos signos con síntomas. El médico deberá considerar la conveniencia de suspender el tratamiento en los casos sintomáticos. Si sobrevienen síntomas, se recomienda un tratamiento conservador no quirúrgico.
Estos precipitados biliares afectan más frecuentemente a los niños ya que estos reciben comparativamente dosis superiores si éstas se ajustan en función de su peso corporal. Por ello, no se deben administrar dosis superiores a 80 mg/kg de peso ya que el riesgo de precipitación biliar se ve incrementado.
En raras ocasiones se han descrito casos de pancreatitis en pacientes tratados con ceftriaxona, cuya posible etiología es una obstrucción biliar. La mayoría de los pacientes presentaban de forma concomitante factores de riesgo de estasis biliar y depósito de sedimentos biliares, tales como una intervención quirúrgica previa, una enfermedad grave, o cuando habían recibido nutrición parenteral. Sin embargo, no se puede descartar un efecto desencadenante o de contribución de la ceftriaxona a la precipitación biliar.
Entre los casos de precipitación de la ceftriaxona a nivel renal la mayoría de ellos se dan en niños mayores de tres años tratados bien con dosis diarias elevadas (por ej. ≥ 80 mg/Kg/día), o con dosis totales superiores a los 10 g, y que presentaban otros factores de riesgo (por ej. restricción de fluidos, confinamiento en cama, etc.). Este efecto puede ser sintomático o asintomático, puede conducir a insuficiencia renal y es reversible al interrumpirse el tratamiento.
Durante los tratamientos prolongados con ceftriaxona deberá controlarse regularmente el perfil hematológico.
Interferencias con pruebas de laboratorio
En raros casos el test de Coombs puede dar falsos positivos en pacientes tratados con ceftriaxona. La ceftriaxona, como otros antibióticos, puede dar falsos positivos en los test para galactosemia.
Asimismo, los métodos no enzimáticos para la determinación de glucosa en orina pueden dar falsos positivos. Por esta razón, durante la terapia con ceftriaxona la determinación de glucosa en orina debe llevarse a cabo mediante métodos enzimáticos.
Interacciones con productos que contienen calcio
Se han descrito casos de reacciones mortales en niños prematuros y en recién nacidos a término de menos de 1 mes de edad por precipitados de calcio-ceftriaxona en pulmones y riñones. Al menos uno de ellos había recibido ceftriaxona y calcio a diferentes tiempos y a través de diferentes líneas intravenosas. En los datos científicos disponibles, no hay informes de precipitados intravasculares confirmados en pacientes, con excepción de recién nacidos, tratados con ceftriaxona y soluciones que contienen calcio o con cualquier otro producto que contenga calcio.
En pacientes con cualquier edad, ceftriaxona no debe mezclarse ni administrarse simultáneamente con ninguna solución IV que contenga calcio, ni incluso por diferentes líneas de perfusión ni en diferentes sitios de perfusión. Sin embargo, en pacientes mayores de 28 días de edad, la ceftriaxona y las soluciones que contienen calcio pueden ser administradas secuencialmente una tras otra si se usan líneas de perfusión en diferentes sitios, o si las líneas de perfusión se substituyen o se limpian con un chorro de solución fisiológica a fondo entre las perfusiones para evitar precipitados. En pacientes que requieren una perfusión continua con soluciones de Nutrición Parenteral Total (NPT) que contienen calcio, los profesionales sanitarios pueden considerar el uso
de tratamientos antibacterianos alternativos que no conlleven un riesgo similar de precipitación. Si el uso de ceftriaxona se considera necesario en pacientes que requieren nutrición continua, las soluciones de NPT y ceftriaxona pueden administrarse simultáneamente, aunque por líneas diferentes de perfusión en sitios diferentes. Alternativamente, la perfusión de solución NPT se puede interrumpir durante el período de infusión de ceftriaxona, considerando la recomendación de limpiar las vías de perfusión entre las soluciones.
Ceftriaxona intramuscular contiene lidocaína en la ampolla de disolvente para aumentar la tolerancia local en su administración. No debe emplearse por vía intravenosa, tampoco en pacientes con historial de hipersensibilidad a la lidocaína.
Los diluyentes que contienen calcio tal como la solución de Ringer o Hartmann no deberán ser usados para reconstitución de viales de ceftriaxona o para diluir los viales reconstituidos para administración intravenosa debido a que pueden formar un precipitado. La precipitación de ceftriaxona-calcio también puede ocurrir cuando la ceftriaxona es mezclada con soluciones que contienen calcio en la misma línea de administración intravenosa. Ceftriaxona no debe ser administrada simultáneamente con soluciones intravenosas que contengan calcio, incluyendo infusiones continuas de calcio tal como la nutrición parenteral a través de una vía en Y.
Este medicamento contiene sodio, debe tenerse en cuenta en los pacientes con una dieta baja en sodio.
e. INTERACCIONES CON OTROS MEDICAMENTOS:
No es aconsejable el uso concomitante de ceftriaxona con antibióticos bacteriostáticos, especialmente en el caso de infecciones agudas. Presencia de efecto antagonista con la combinación de ceftriaxona y cloranfenicol.
La administración simultánea de probenecid a dosis altas (1 ó 2 gramos diarios) puede inhibir la excreción biliar de ceftriaxona. A diferencia de otras cefalosporinas, el probenecid no inhibe la secreción tubular de ceftriaxona.
La eficacia anticonceptiva de los anticonceptivos hormonales puede verse afectada por la administración simultánea de ceftriaxona. Por tanto, se recomienda adoptar medidas adicionales durante el período de tratamiento y en el mes siguiente.
f. EMBARAZO Y LACTANCIA:
Embarazo:
No se dispone de datos clínicos del uso de ceftriaxona en mujeres embarazadas expuestas. No existen pruebas experimentales de efectos embriopáticos o teratogénicos en animales. Ceftriaxona deberá utilizarse durante el embarazo sólo si los beneficios superan los posibles riesgos para el feto.
Lactancia:
Dado que ceftriaxona se excreta en la leche materna, se usará con precaución en mujeres en período de lactancia.
g. EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR Y MANEJAR MAQUINARIA:
La influencia sobre la capacidad para conducir y utilizar máquinas es insignificante, aunque se debe tener en cuenta que ocasionalmente se puede producir mareo.
h. REACCIONES ADVERSAS:
El alto riesgo de precipitados en recién nacidos es debido al bajo volumen sanguíneo y a la semivida de Ceftriaxona más larga en comparación con adultos.
Se ha utilizado la siguiente terminología para clasificar la aparición de reacciones adversas: muy frecuentes (≥ 1/10); frecuentes (≥ 1/100 a <1/10); poco frecuentes (≥ 1/1.000 a <1/100); raras (≥ 1/10.000 a <1/1.000); muy raras (<1/10.000) y frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
| Clasificación de órganos del sistema |
Reacciones adversas |
Categorías de frecuencia |
| Infecciones e infestaciones | Vulvovaginitis | Raras |
|
Trastornos de la sangre y del sistema linfático |
Anemia (incluyendo anemia hemolítica) | Raras |
| Leucocitopenia | Raras | |
| Granulocitopenia Trombocitopenia | Raras | |
| Eosinofilia | Raras | |
| Trastornos de la coagulación | Muy raras | |
| Agranulocitosis (sobre todo tras 10 dias de tratamiento o tras dosis elevadas) | Muy raras | |
| Trastornos del sistema inmunológico | Reacciones anafilácticas o anafilactoides | Raras |
| Urticaria | Raras | |
| Trastornos del sistema nerviosos | Cefalea | Raras |
| Mareo | Raras | |
|
Trastornos gastrointestinales |
Diarrea | Frecuentes |
| Nauseas | Frecuentes | |
| Estomatitis | Frecuentes | |
| Glositis | Frecuentes | |
| Colitis pseudomembranosa | Muy raras | |
| Pancreatitis | Muy raras | |
| Hemorragia gastrointestinal | Muy raras | |
|
Trastornos hepatobiliares |
Precipitación sintomática de Ceftriaxona cálcica en la vesicula biliar | Raras |
| Aumento de los enzimas hepáticos | Raras | |
|
Trastornos de la piel y tejido subcutáneo |
Exantema | Poco frecuentes |
| Dermatitis alérgica | Poco frecuentes |
| Rash | Poco frecuentes | |
| Edema | Poco frecuentes | |
| Eritema multiforme | Poco frecuentes | |
| Sindrome de Stevens-Johnson | Muy raras | |
| Necrólisis epidérmica tóxica o síndrome de Lyell | Muy raras | |
|
Trastornos renales y urinarios |
Oliguria | Raras |
| Aumento de la creatinina sérica | Raras | |
| Precipitación renal de Ceftriaxona sódica en pacientes pediátricos. | Muy raras | |
| Hematuria | Muy raras | |
| Trastornos generales y alteraciones en el lugar de
administración |
Fiebre | Raras |
| Escalofrios | Raras |
Pueden presentarse dolores transitorios en el lugar de la inyección intramuscular, siendo la más probable que ocurra con dosis más elevadas.
i. SOBREDOSIFICACION:
La sobredosis con cefalosporinas por vía parenteral puede dar lugar a convulsiones, así como a alteraciones gastrointestinales. En caso de sobredosis se deberá suspender de inmediato la administración del fármaco e iniciarse un tratamiento sintomático y de sostén. No existe antídoto específico y ceftriaxona no se elimina por diálisis.
DATOS FARMACÉUTICOS
a. INCOMPATIBILIDADES:
Las soluciones que contengan ceftriaxona no se deben mezclar ni se les debe añadir otros agentes. En particular los diluyentes que contengan calcio, (Por Ej., solución Ringer, solución Hartmann) no se deben usar para reconstituir los viales de ceftriaxona ni para diluir los viales reconstituidos cuando vaya a ser administrado por vía intravenosa ya que puede formar precipitados. La Ceftriaxona no debe mezclarse ni administrarse simultáneamente con soluciones que contengan calcio. Ceftriaxona es incompatible con amsacrina, vancomicina, fluconazol, y aminoglucósidos.
b. PERIODO DE VALIDEZ:
AXTAR® IM: 36 meses AXTAR® IV: 36 meses
*Las preparaciones reconstituidas deben administrarse inmediatamente y desechar el sobrante.
c. PRECAUCIONES ESPECIALES DE CONSERVACIÓN: almacenar a temperatura no mayor de 30°C.
d. NATURALEZA Y CONTENIDO DEL ENVASE:
AXTAR ® 0.5g IV
Farmacia:
Caja con un frasco vial + ampolla con 5ml de agua estéril para inyección.
Hospital:
Caja con 50 frascos
AXTAR ® 0.5g IM
Muestra Medica:
Caja con un frasco vial + ampolla de 2ml de
Farmacia:
Caja con un frasco vial + ampolla de 2ml de solvente
Caja conteniendo dos cajas con un frasco vial + ampolla de 2ml de solvente.
Caja conteniendo tres cajas con un frasco vial + ampolla de 2ml de solvente.
Hospital:
Caja con 50 frascos viales
Caja con 405 frascos viales Caja con 1, 000 frascos viales
AXTAR ® 1.0g IM
Muestra medica:
Caja con 1 frasco vial + ampolla de 3.5ml de solvente
Farmacia:
Caja con 1 frasco vial + ampolla de 3.5ml de solvente
Caja conteniendo dos cajas con un frasco vial + ampolla de 3.5ml de solvente.
Caja conteniendo tres cajas con un frasco vial + ampolla de 3.5ml de solvente.
Hospital:
Caja con 50 frascos viales
Caja con 1,000 frascos viales Caja con 405 frascos viales
AXTAR ® 1.0g IV
Muestra Medica:
Caja con 1 frasco vial + ampolla de 10ml de
Farmacia:
Caja con 1 frasco vial + ampolla de 10ml de solvente
Hospital:
Caja con 50 frascos viales
NOTA: se aclara que no todas las presentaciones descritas en este apartado se comercializan en todos los países en donde se encuentra registrado el producto.
REFERENCIAS BIBLIOGRÁFICAS
-Agencia Española de Medicamentos. AEMPS. Ficha Técnica disponible en: https://cima.aemps.es/cima/dochtml/ft/62635/FT_62635.html, fecha de revisión: Jul 16
– Agencia Española de Medicamentos. AEMPS. Ficha Técnica disponible en: https://cima.aemps.es/cima/dochtml/ft/62641/FT_62641.html, fecha de revisión: Jul 16