Forma Farmacéutica y Formulación
Forma Farmacéutica
Solución Inyectable
Presentación
Ampolla I
Cada 2 mL de solución inyectable contienen:
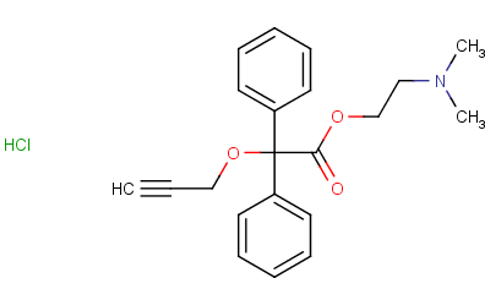
Propinox clorhidrato…15.00 mg
Vehículo c.s.p.
Ampolla II
Cada 2 mL de solución inyectable contienen:
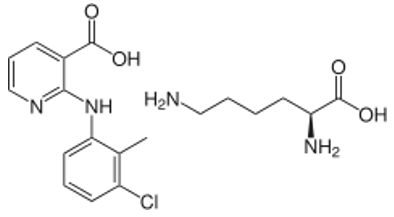
Clonixinato de lisina…100.00 mg
Vehículo c.s.p.
DATOS CLÍNICOS
a. Indicaciones terapéuticas:
Espasmo Dolofor® está indicado para el tratamiento del dolor leve a moderado asociado a dismenorrea primaria, estados espasmódicos del intestino y para el tratamiento del cólico renal (uretral). a
b. Posología y forma de administración:
Vía de administración: Intramuscular e intravenosa.
Dosis:
Dosis usual en adultos: 1 a 4 dosis diarias administradas por vía intramuscular o intravenosa (lenta). En caso necesario puede administrarse 2 dosis juntas.
La inyección intravenosa debe efectuarse directamente en bolo (lenta) y no utilizando tubuladura de perfusión. a
Indicaciones de uso:
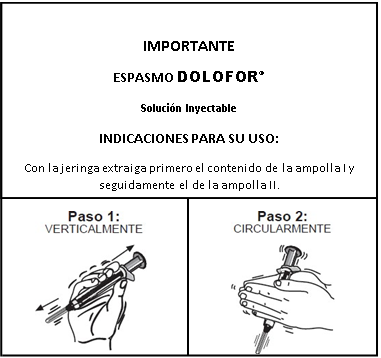
c. Contraindicaciones:
- Hipersensibilidad a cualquiera de los componentes de la fórmula.
- Úlcera péptica activa o hemorragia gastroduodenal
- Antecedentes de broncoespasmo, pólipos nasales, angioedema o urticaria ocasionados por la administración de ácido acetilsalicílico (aspirina) u otros antiinflamatorios no esteroides.
- Glaucoma, hipertrofia de próstata o tendencia a la retención urinaria y estenosis pilórica orgánica.
- Atonía intestinal, íleo paralítico, colitis ulcerosa, Miastemia gravis.
- Embarazo y Lactancia.
- Niños menores de 12años.
d. Advertencias y precauciones especiales de empleo:
Se debe suspender el tratamiento si se presentan reacciones alérgicas en la piel y/o mucosas o síntomas de úlcera péptica o de hemorragia gastrointestinal.
Los pacientes en tratamiento con antiinflamatorios no esteroides pueden presentar toxicidad gastrointestinal seria como: ulceración, sangrado y perforación en cualquier momento, con o sin síntomas de alerta previos. Los pacientes con antecedentes de eventos gastrointestinales serios, otros factores de riesgo asociados con la úlcera péptica (alcoholismo, tabaquismo) y los pacientes ancianos o debilitados presentan un riesgo mayor. a
En dosis superiores a las habituales también puede inhibir la sudoración con el consiguiente aumento de la temperatura corporal, hecho que debe tenerse en cuenta en pacientes con fiebre o en ambientes con temperatura elevada. a
Debido a la posibilidad de efectos anticolinérgicos, especialmente en pacientes sensibles o cuando se usan dosis elevadas, debe emplearse con precaución en pacientes con predisposición a la obstrucción intestinal o urinaria. a
Los medicamentos con acción anticolinérgica pueden aumentar la frecuencia y la conducción cardíaca, por tal motivo se recomienda administrarlos con precaución a pacientes con tirotoxicosis, insuficiencia cardíaca, hipertensión arterial, cardiopatía isquémica y estenosis mitral. También pueden relajar el esfínter esofágico inferior, por lo cual deberían evitarse en pacientes con reflujo gastroesofágico o hernia hiatal.a
Administrarlo con precaución en pacientes con antecedentes digestivos, de úlcera péptica gastroduodenal o gastritis. a
Aunque no se ha descrito caso alguno durante la administración de Clonixinato de lisina, es sabido que los antiinflamatorios no esteroides en general, inhiben la síntesis de prostaglandinas que promueven la irrigación renal. En enfermos cuya perfusión renal se encuentra disminuida, la administración de estos fármacos puede precipitar una descompensación de la función renal, generalmente reversible al interrumpir el tratamiento con el fármaco en cuestión. Particularmente susceptibles a esta complicación, son los pacientes deshidratados, con insuficiencia cardíaca congestiva, cirrosis hepática, síndrome nefrótico u otras enfermedades renales evidentes, aquellos que reciben diuréticos, o bien los que han sido sometidos a intervenciones quirúrgicas mayores con hipovolemia subsiguiente. En estos enfermos se controlará el volumen de la diuresis y la función renal al iniciar el tratamiento. a
Un efecto que puede observarse ocasionalmente durante la terapéutica con antiinflamatorios no esteroides, nunca referido durante el tratamiento con Clonixinato de lisina, es la elevación de los niveles plasmáticos de las transaminasas o de otros parámetros de la función hepática. En la mayoría de los casos el aumento sobre los niveles normales es pequeño y transitorio. a
Uso pediátrico: No se dispone de estudios sobre la seguridad en niños menores de 12 años de edad, por lo tanto, su uso está contraindicado en ellos. a
Uso geriátrico: Los pacientes ancianos pueden presentar una mayor sensibilidad a los anticolinérgicos y a los antiinflamatorios no esteroides, reflejada por una mayor incidencia de efectos adversos (acidez, gastritis, retención urinaria, estreñimiento, sequedad bucal, etc.). Se recomienda administrarlo con precaución por el riesgo de glaucoma no diagnosticado. a
Este medicamento contiene Propilenglicol, puede producir síntomas parecidos a los del alcohol por lo que puede disminuir la capacidad de conducir o manejar maquinaria.
e. Interacciones con otros medicamentos y otras formas de interacción: Propinox clorhidrato:
Administrar con precaución a pacientes que se encuentren recibiendo medicamentos anticolinérgicos u otros medicamentos que puedan presentar efectos anticolinérgicos (antidepresivos tricíclicos, antihistamínicos, quinidina, fenotiazinas, etc.). En estos casos puede producirse una sumatoria de efectos. a
Los antidiarreicos adsorbentes y los antiácidos pueden disminuir la absorción de los anticolinérgicos. a
Los efectos inhibitorios sobre la secreción ácida gástrica, con el consiguiente aumento del pH gástrico, pueden producir disminución de la absorción del ketoconazol y el itraconazol. a
Clonixinato de lisina:
Glucocorticoides, otros antiinflamatorios no esteroides (incluyendo ácido acetilsalicílico en altas dosis) y alcohol: Aumento de riesgo de úlcera gastroduodenal y hemorragias por acción sinérgica. b
Anticoagulantes orales, ticlopidina, heparina (administración sistémica), trombolíticos: Mayor riesgo de hemorragia. Si la administración concomitante es inevitable, se efectuarán controles estrictos de la coagulación sanguínea, ajustando las dosis de los medicamentos que la modifican de acuerdo a los resultados. Se ha demostrado que el Clonixinato de lisina administrado en dosis terapéuticas no afecta la farmacocinética y la actividad anticoagulante del Fenprocumon.b
Litio: Los antiinflamatorios no esteroides en general aumentan los niveles plasmáticos de litio. Se controlará la concentración plasmática de litio al comenzar, modificar o suspender la administración. a
Metotrexato: El tratamiento simultáneo con metotrexato y antiinflamatorios no esteroides, puede aumentar la toxicidad hematológica del metotrexato. En estos casos deben efectuarse controles hematológicos estrictos. a
Diuréticos: En los pacientes deshidratados, el tratamiento con antiinflamatorios no esteroides aumenta el riesgo potencial de insuficiencia renal aguda. En caso de tratamiento concomitante con Clonixinato de lisina y diuréticos, se deberá hidratar adecuadamente a los pacientes y controlar la función renal antes de comenzar el mismo. a
Antihipertensivos (por ejemplo, beta bloqueante, inhibidores de la ECA, vasodilatadores, diuréticos): Se ha comunicado una disminución de la eficacia antihipertensiva por inhibición de las prostaglandinas vasodilatadoras durante el tratamiento simultáneo con antiinflamatorios no esteroides. a
f. Embarazo y lactancia:
Embarazo: No existe experiencia suficiente con la administración en mujeres embarazadas. Por lo tanto, no debe ser administrado durante el embarazo. a
Lactancia: El Clonixinato de lisina se elimina en la leche en pequeñas cantidades, pero se desconoce si el Propinox pasa a leche materna. Los anticolinérgicos inhiben la lactancia. Por lo tanto, Espasmo dolofor® no debe ser administrado durante la lactancia. a
El uso del Clonixinato de lisina puede disminuir la fertilidad femenina y no se recomienda su uso en mujeres que intenten quedar embarazadas. En mujeres que tengan dificultad para concebir o que se encuentren en fase de investigación de infertilidad, se debe considerar la suspensión del tratamiento con Clonixinato de lisina. b
g. Efectos sobre la capacidad para conducir y manejar maquinara:
La administración de dosis elevadas puede producir trastornos de la acomodación; por lo tanto, se recomienda administrarlo con precaución y evitar la conducción de vehículos y la operación de maquinarias peligrosas hasta lograr la normalización de la visión. a
h. Reacciones adversas:
En pacientes particularmente sensibles o con la administración de dosis elevadas, puede aparecer epigastralgia, acidez, náuseas, vómitos, sequedad bucal, constipación, diarrea, visión borrosa, mareos, somnolencia, cefalea, palpitaciones o taquicardia, modificables mediante un ajuste posológico. Dolor en el lugar de la inyección. a
Más raramente: Alergia cutánea, gastritis, sangrado gastrointestinal, retención urinaria, aumento de la presión intraocular, cansancio, disminución de la memoria. Con otros AINEs se han informado, además: Edema, retención de líquidos y úlcera gastroduodenal con o sin hemorragia y/o perforación. a
Las reacciones adversas del tratamiento con Clonixinato de lisina son, en general, raras: Estas se presentan agrupadas según su frecuencia (muy frecuentes: >1/10; frecuentes:
>1/100, <1/10; poco frecuentes: >1/1.000, <1/100; raras: >1/10.000, <1/1.000, muy raras:
<1/10.000) y según la clasificación de órganos y sistemas:
- Trastornos de la sangre y del sistema linfático:
Muy raros: alteraciones hematológicas (agranulocitosis, anemia aplásica, trombocitopenia, anemia hemolítica).
- Trastornos del Sistema nervioso: Muy raros: vértigos.
- Trastornos respiratorios, torácicos y mediastínicos: Muy raros: broncoespasmo y disnea.
- Trastornos gastrointestinales:
Frecuentes: malestar, dolor de estómago, sensación de plenitud gástrica o acidez gástrica (que desaparecen habitualmente sin necesidad de suprimir el tratamiento), náuseas, vómitos, diarreas y un mínimo sangrado intestinal.
Raros: gastritis, hematesis.
- Trastornos de la piel y del tejido subcutáneo:
Muy raros: reacciones de hipersensibilidad (alergia), con rash cutáneo y prurito, eccema maculopapular, y alteraciones de la piel.
- Otros trastornos:
Muy raros: insomnio, sofocación, temblor, faringitis, fiebre, cansancio y falta de apetito. b
Para el Propinox clorhidrato: existen efectos que se presentan rara vez, pero son severos y en caso de presentarse debe acudir en forma inmediata al médico: retención urinaria, visión borrosa, taquicardia, dolores de cabeza, mareos, insomnio, reacciones alérgicas.c
Otros efectos
Pueden presentarse otros efectos que habitualmente no necesitan atención médica, los cuales pueden desaparecer durante el tratamiento, a medida que su cuerpo se adapta al medicamento. Sin embargo, consulte a su médico si cualesquiera de estos efectos persisten o se intensifican: sequedad bucal, estreñimiento, dilatación de la pupila con pérdida de la acomodación y fotofobia leve.c
i. Sobredosificación:
No se han informado casos de sobredosis. Sin embargo, se supone que los síntomas de sobredosis corresponden a los de los anticolinérgicos (retención urinaria, sequedad bucal, rubor cutáneo, taquicardia, bloqueo de la motilidad gastrointestinal, trastornos de la visión) o a los efectos de los AINEs sobre el aparato digestivo (acidez, epigastralgia, náuseas, gastritis, úlcera). También puede presentarse hipertermia, confusión, ataxia, excitación y alucinaciones. Se recomienda efectuar control clínico estricto (especialmente gastroduodenal y de la función renal) y tratamiento de soporte y de los posibles síntomas anticolinérgicos. No se han descrito antídotos específicos. No se recomienda el uso de fisostigmina. Las fenotiazinas pueden potenciar el efecto anticolinérgico. La hemodiálisis posiblemente carezca de valor debido a la elevada unión proteica del Propinox y el Clonixinato de lisina. a
PROPIEDADES FARMACOLÓGICAS
a. Propiedades farmacodinámicas:
El Propinox es un antiespasmódico antagonista moderado y no selectivo de los receptores muscarínicos y con acción directa sobre el músculo liso visceral. a
El Clonixinato de lisina es un analgésico antiinflamatorio no esteroide (AINE), con acción analgésica predominante. Su acción se desarrolla por inhibición de la síntesis de prostaglandinas. Estudios recientes sugieren que dicha acción es predominante sobre la enzima catalizadora de la síntesis de prostaglandinas mediadoras de la inflamación (ciclooxigenasa 2 o COX-2) con menor actividad sobre la enzima catalizadora de la síntesis de prostaglandinas de la mucosa gastrointestinal y de los riñones (ciclooxigenasa 1 o COX-1), donde dichas sustancias ejercen una función protectora. a
Se ha demostrado que los productos derivados de la 5-lipooxigenasa son ulcerogénicos.
Clonixinato lisina inhibe la formación de estos productos. b
b. Propiedades farmacocinéticas:
Propinox clorhidrato: El Propinox presenta una vida media de eliminación plasmática de 4 horas y un volumen de distribución de 2 l/kg. La unión a las proteínas plasmáticas es de 91%. Si bien no hay datos al respecto, debe contemplarse la posibilidad de que atraviese las barreras hematoencefálica y placentaria y que se elimine en la leche. La eliminación se realiza mediante biotransformación hepática. a
Clonixinato de lisina: La vida media plasmática del Clonixinato de lisina en seres humanos es de 1.75 ± 0.10 horas. Presenta una elevada unión a las proteínas del plasma (97.4 ± 2.2 %) la eliminación es bajo la forma de metabolitos, principalmente en la orina (60 %).
La concentración en la leche es 7 a 10 % de la concentración plasmática. a
c. Datos preclínicos de seguridad:
Estudios de toxicidad administrando dosis elevadas de Clonixinato lisina produjeron en algunas especies alteraciones gastrointestinales. Estudios practicados en ratas y conejos no mostraron alteraciones en la fertilidad, capacidad de reproducción ni toxicidad embrionaria. Los estudios realizados tanto “in vitro” como “in vivo” no han mostrado trastornos mutagénicos ni carcinogénicos. b
DATOS FARMACÉUTICOS
a. Periodo de validez
36 meses
b. Precauciones especiales de conservación
No conservar a temperatura superior a 30ºC
c. Naturaleza y contenido del envase
Envase:
Ampolla I: ampolla de vidrio tipo I claro de 2 mL.
Ampolla II: ampolla de vidrio tipo I ámbar de 2 mL.
Presentaciones:
Farmacia:
Caja con 1 y 3 ampollas I (Propinox clorhidrato) (vidrio claro tipo I) de 2 mL + 1 y 3 ampollas II (Clonixinato de lisina) (vidrio ámbar tipo I) de 2 mL (en blíster de PVC/aluminio full color impreso).
Caja con 1 ampolla I (Propinox clorhidrato) (vidrio claro tipo I) de 2 mL + 1 ampolla II (Clonixinato de lisina) (vidrio ámbar tipo I) de 2 mL (en blíster de PVC/aluminio full color impreso) + jeringa desechable.
Muestra médica:
Caja con 1 y 3 ampollas I (Propinox clorhidrato) (vidrio claro tipo I) de 2 mL + 1 y 3 ampollas II (Clonixinato de lisina) (vidrio ámbar tipo I) de 2 mL (en blíster de PVC/aluminio full color impreso).
Caja con 1 ampolla I (Propinox clorhidrato) (vidrio claro tipo I) de 2 mL + 1 ampolla II (Clonixinato de lisina) (vidrio ámbar tipo I) de 2 mL (en blíster de PVC/aluminio full color impreso) + jeringa desechable.
Hospitalaria:
Caja con 3 ampollas I (Propinox clorhidrato) (vidrio claro tipo I) de 2 mL + 3 ampollas II (Clonixinato de lisina) (vidrio ámbar tipo I) de 2 mL (en blíster de PVC/aluminio full color impreso).
REVISIÓN DEL TEXTO
Versión 1 – Agosto 2018
REFERENCIAS BIBLIOGRÁFICAS
- . Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Ficha técnica disponible en: https://www.aemps.gob.es/cima/publico/home.html
- Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT). https://argentina.gob.ar/anmat
- Instituto de Salud Pública de Chile (ISP). http://www.ispch.cl/
- Martindale. (2017). The Complete Drug Reference. 39th Edition. Great Britain: Pharmaceutical Press. Pp. 41, 1912.