Forma Farmacéutica y Formulación
Forma Farmacéutica
Tabletas de Disolución Bucal
Composición Cualitativa y Cuantitativa
Cada tableta de disolución bucal contiene:
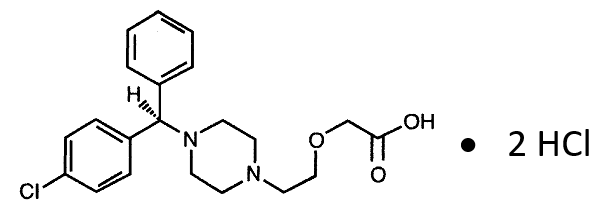
Levocetirizina diclorhidrato…5 mg
Excipientes c.s.p.
PROPIEDADES FARMACOLÓGICAS
a. FARMACODINAMIA:
La Levocetirizina es un antihistamínico de segunda generación. Es el enantiómero (R) activo de la cetirizina que es un antagonista selectivo de los receptores periféricos H1 (1,2).
La Levocetirizina tiene una gran afinidad por los receptores H1. En estudios in vitro sobre la unión a los receptores, la levocetirizina demostró dos veces mayor afinidad por los receptores H1 que la cetirizina, la relevancia clínica de este hallazgo es incierta (2).
La Levoceterizina parece ser tan potente como la cetirizina en inhibir los estornudos inducidos por la histamina, aumentar la resistencia en la vía área nasal, habones y prurito; la relevancia clínica de las pruebas cutáneas de histamina-habones es incierta. La levocetirizina también ha mostrado en exhibir mayor y más inhibición de histamina inducida por habones y prurito comparada con otros antihistamínicos (Ejemplo: desloratadina, fexofenadina, loratadina) (2).
b. FARMACOCINÉTICA:
La farmacocinética de levocetirizina es lineal respecto a la dosis e independiente del tiempo, con baja variabilidad entre los sujetos (4,5).
Absorción: Levocetirizina se absorbe extensa y rápidamente después de la administración oral. La comida, parece no tener efecto sobre la absorción, aunque el índice de absorción disminuye. La concentración plasmática pico se alcanza en aproximadamente 0.9 horas después de la dosis administrada. El estado estable se alcanza después de dos días (4).
Distribución: La levocetirizina se une en un 90% a las proteínas del plasma. El volumen de distribución es aproximadamente de 0.4 l/kg (4).
Metabolismo: La extensión del metabolismo de levoceterizina en humanos es menor del 14% de la dosis. Las rutas metabólicas incluyen una oxidación aromática, N- y O-desalquilación y conjugación taurina. Las rutas de desalquilación están principalmente mediadas por CYP 3A4 mientras que la oxidación aromática involucra isoformas CYP múltiples y/o no identificadas (4).
Excreción: La vida media del plasma de levocetirizina en adultos es de 7.9±1.9 horas. El promedio aparente de aclaramiento corporal total es 0.63 ml/min/kg. La principal vía de excreción de levocetirizina y metabolitos es la orina, calculando un promedio de 85.4% de la dosis. La excreción por las heces cuenta por solo 12.9% de la dosis. La levocetirizina es excretada por filtración glomerular y secreción tubular (4).
DATOS CLÍNICOS
a. INDICACIONES:
Minadyn® 5 mg es recomendado para el alivio sintomático de rinitis alérgica y urticaria (1, 2).
b. POSOLOGÍA Y FORMA DE ADMINISTRACIÓN:
Administración: Oral.
Adultos: 5 mg/ día (1 tableta diaria, o como se prescribió) (1,2).
Límite: Máximo 5 mg/día, mayores dosis (Ej. 10 mg/día) está asociado a un incremento en el riesgo de la somnolencia (2).
Niños: 12 años en delante: 5 mg /día (2)
Límite: Máximo 5 mg/día (2).
Falla hepática:
No se requiere ajuste de dosis (2).
Falla renal: Niños 12 años en adelante y Adultos: Ajuste de dosis basados en el grado de falla renal (Ver Tabla No1).
Tabla No. 1 Dosis para el tratamiento sintomático de Rinitis alérgica y urticaria idiopática en adultos y niños de 12 años y mayores con falla renal:
| Aclaramiento de creatinina
(mL/minuto) |
Dosis |
| 50-80 | 2.5 mg una vez al día |
| 30-50 | 2.5 mg cada otro día |
| 10-30 | 2.5 mg dos veces a la semana (administrados cada 3-4 días) |
| <10 (o que reciben hemodiálisis) | Uso contraindicado |
Pacientes geriátricos: La dosis se debe seleccionar con precaución por la relación edad-decremento en las funciones hepáticas, renales y cardiacas y enfermedad concomitante y terapia con medicamentos (2).
c. CONTRAINDICACIONES:
Minadyn® 5 mg está contraindicado en personas hipersensibles a cualquiera de sus ingredientes, o sean alérgicos a los derivados de piperazina, o hidroxizina o cetirizina.
Los pacientes con fenilcetonuria no deben consumir este producto, contiene ASPARTAMO que se metaboliza a fenilalanina, que puede causar toxicidad.
Está contraindicado en pacientes con insuficiencia renal grave y aclaramiento de creatinina menor a 10 mL/min (2).
d. ADVERTENCIAS Y PRECAUCIONES:
Durante el embarazo y la lactancia (categoría B).
Se espera que se distribuya en la leche materna (La cetirizina se distribuye en la leche materna), por lo que no se recomienda su uso.
Los que toman Minadyn® 5 mg deben tener cuidado en la realización de actividades que requieran de vigilancia (ej.: operar vehículos o máquinas, trepar alturas), ya que se ha reportado somnolencia, fatiga y astenia por su uso.
Es preferiblemente evitar la combinación del alcohol con levocetirizina o con depresivos del sistema nervioso central (SNC).
Minadyn® 5 mg debe ser administrado con precaución en pacientes con disfunción renal o hepática.
No se recomienda utilizar las tabletas de levocetirizina en niños menores de 12 años ya que las tabletas disponibles no permiten un ajuste de la dosis. Se recomienda el uso de una formulación pediátrica de levocetirizina.
Información importante sobre excipientes:
- Aspartamo: Este medicamento contiene 4mg de aspartamo en cada tableta de Minadyn 5mg. El aspartamo contiene una fuente de fenilalanina que puede ser perjudicial en caso de padecer fenilcetonuria (FCN), una enfermedad genética rara en la que la fenilalanina se acumula debido a que el organismo no es capaz de eliminarla correctamente.
No hay datos clínicos o preclínicos disponibles que permitan evaluar el uso de aspartamo en lactantes por debajo de 12 semanas de edad.
- Manitol: Puede producir un efecto laxante leve.
e. INTERACCIÓN CON MEDICAMENTOS:
No hay estudios formales de interacción de medicamentos con Levocetirizina a la fecha, los estudios se han hecho con mezclas racémicas de cetirizina (2).
No inhibe el citocromo P-450 (CYP) isoenzimas 1A2, 2C9, 2C19, 2A1, 2D6, 2E1 o 3A4. No induce la uridina difosfato-glucuronisiltransferasa (UGT) 1A o CYP isoenzimas 1A2, 2C9 o 3A4. No es probable que produzca o sea sujeto de interacciones farmacocinéticas asociadas con sistemas metabólicos enzimáticos (2).
- Azitromicina: No hay cambios clínicamente importantes en los parámetros de ECG observados seguidamente por el uso concomitante con cetirizina, y no hay interacciones clínicamente importantes reportadas seguidas por el uso concomitante (2).
- Depresores del SNC (Ej. Alcohol): Posiblemente efectos aditivos. Evitar el uso concomitante (2).
- Cimetidina: No se observaron interacciones farmacocinéticas con cetirizina (2).
- Eritromicina: No hay cambios clínicamente importantes en los parámetros de ECG observados seguidamente por el uso concomitante con cetirizina, y no hay interacciones clínicamente importantes reportadas seguidas por el uso concomitante (2).
- Ketoconazol: Prolongación del intervalo QTc (con un incremento de 17.4 msec), observados seguidamente por el uso concomitante con cetirizina, no se han reportado interacciones clínicamente importantes seguidas por el uso concomitante (2).
- Pseudoefedrina: No se han observado interacciones farmacocinéticas con cetirizina (2).
- Ritonavir: Incremento en el área bajo la curva de concentración-tiempo del plasma (AUC) (42%), incremento de la vida media (53%) y disminución de la depuración (29%) de cetirizina, la disposición del ritonavir no se observó alterada seguidamente por el uso concomitante con cetirizina (2).
- Teofilina: Disminución de la depuración (16%) de cetirizina, la disposición de la teofilina no se observó alterada seguidamente por el uso concomitante con cetirizina (2).
No se han realizado ensayos de interacción con levocetirizina, ensayos realizados con el compuesto racémico cetirizina han demostrado que no había interacciones clínicamente relevantes (con antipirina, azitromicina, cimetidina, diazepam, eritromicina, glipizida, ketoconazol y pseudoefedrina). En un ensayo de dosis múltiples con teofilina (400 mg, una vez al día) se observó una ligera disminución (16%) en el aclaramiento de cetirizina, mientras que la disposición de teofilina no se alteró con la administración concomitante de cetirizina.
f. EMBARAZO Y LACTANCIA:
- Embarazo: Categoría B en el embarazo
- Lactancia: se espera que levocetirizina se distribuya en la leche. El uso no es recomendado en mujeres en periodo de lactancia.
g. EFECTOS SOBRE LA CAPACIDAD DE CONDUCIR MAQUINARIA: los pacientes que van a conducir, realizar actividades potencialmente peligrosas o utilizar maquinas, deberán tener en cuenta su respuesta al medicamento.
h. REACCIONES ADVERSAS:
El efecto secundario más común de levocetirizina (Minadyn® 5 mg) es la somnolencia (2,4).
Los otros efectos adversos significativos son fatiga, boca seca, dolor de cabeza (2,4,5,6).
Además de las reacciones adversas notificadas anteriormente, se han notificado casos muy raros de las siguientes reacciones adversas: dolor de estómago, comportamiento agresivo, resultados anormales del laboratorio, reacciones alérgicas, angioedema, dificultades al respirar, convulsiones, problemas en la visión, agitación, reacciones de hipersensibilidad incluyendo anafilaxia, problemas hepáticos, dolor y/o debilidad muscular, náusea, palpitaciones, urticaria, erupción en la piel, aumento de peso (4,5,6).
Los eventos adversos con frecuencia desconocida reportados, son:
| Trastornos inmunológicos: | Hipersensibilidad incluyendo anafilaxia |
| Trastornos del Metabolismo y nutrición: | Aumento del apetito |
| Trastornos psiquiátricos: | Agresión, agitación, alucinación, depresión, insomnio, pensamientos suicidas, pesadillas. |
| Trastornos del sistema nervioso: | Convulsión, parestesia, mareos, síncope, temblor, disgeusia, |
| Trastornos del oído y del laberinto: | Vértigo |
| Trastornos oculares: | Alteraciones visuales, visión borrosa, crisis oculógira |
| Trastornos cardíacos: | Palpitaciones, taquicardia |
| Trastornos respiratorios, torácicos y mediastínicos: | Disnea |
| Trastornos gastrointestinales: | Náuseas, vómitos, diarrea |
| Trastornos hepatobiliares: | Hepatitis |
| Trastornos biliares y urinarios: | Disuria, retención urinaria |
| Trastornos de la piel o del tejido subcutáneo: | Edema angioneurótico, erupción fija del fármaco, prurito, erupción, urticaria |
| Trastornos musculoesqueléticos y del tejido conjuntivo: | Mialgia, artralgia |
| Trastornos generales y alteraciones en el lugar de la administración: | Edema |
| Exploraciones complementarias: | Incremento de peso, pruebas de la función hepática alteradas. |
i. SOBREDOSIS:
La sobredosis puede resultar en intranquilidad e irritabilidad seguida por somnolencia. Si la sobredosis ocurre, el tratamiento debe ser sintomático o de apoyo, tomando en cuenta cualquier medicamento ingerido concomitantemente. No existe un antídoto específico conocido para levocetirizina. Levocetirizina no se remueve efectivamente por diálisis.
El lavado gástrico se podrá realizar tras una ingesta a corto plazo.
DATOS FARMACÉUTICOS
a. PERIODO DE VALIDEZ:
24 meses
b .PRECAUCIONES ESPECIALES DE CONSERVACIÓN:
Temperatura: No mayor de 30 ºC. Proteger de la luz y la humedad. Mantener fuera del alcance de los niños.
c. NATURALEZA Y CONTENIDO DEL ENVASE:
Muestra médica:
Caja x 2 tabletas de disolución bucal
Caja x 4 tabletas de disolución bucal
Caja x 10 tabletas de disolución bucal
Comercial:
Caja x 10 tabletas de disolución bucal
Caja x 30 tabletas de disolución bucal
Caja x 50 tabletas de disolución bucal
Caja x 100 tabletas de disolución bucal
FECHA DE REVISIÓN
Agosto – 2019
REFERENCIAS BIBLIOGRÁFICAS
- The Complete Drug Reference. 37 ed. 2011. Pp. 634.
- Drug Information. 2011. Pp. 40-41.
- Stockley’s Interacciones Farmacológicas. 3 ed. 2009. Pp.26-27.
- Levocetirizine Dihydrochloride. http://dailymed.nlm.nih.gov
- Levocetirizina Diclorhidrato. Agencia española de medicamentos y productos sanitarios. Ministerio de sanidad y política social.
- Levocetirizine Dihydrochloride. http://www.medicines.org.uk/guides
- AHFS Drug Information, (2017). American Hospital Formulary Service. United Strates of America: American Society of Health-System Pharmacists.